
已知1~18号元素的离子aW3+、bX+、cY2—、dZ—都具有相同的电子层结构,下列关系正确的是( )
A.质子数:c>d B.离子的还原性:Y2—>Z —
C.氢化物的稳定性:H2Y>HZ D.原子半径:X<W
B
【解析】
试题分析:对于原子来说核内的质子数与核外的电子数相等。原子失去电子变为阳离子,原子获得电子变为阴离子。1~18号元素的离子aW3+、bX+、cY2—、dZ—都具有相同的电子层结构。A.则质子数:a>b>d> c。所以错误。B.对于电子层结构相同的微粒来说,核电荷数越大,离子半径就越小,离子失去电子的能力就越弱,所以还原性Y2—>Z — 。正确。C.元素的非金属性越强,其对应的氢化物的稳定性就越强。非金属性:Z>Y,所以稳定性HZ> H2Y。错误。D.X、W是同一周期的元素,原子序数W>X。元素序数越大,原子半径就越小。因此原子半径:X>W。错误。
考点:考查具有相同的电子层结构的微粒的性质的知识。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2016届天津市五区县高一上学期期末考试化学试卷(解析版) 题型:选择题
将饱和溶液FeCl3加入沸水中能制得Fe(OH)3胶体,下列有关说法正确的是
A.溶液和胶体的本质区别是能否发生丁达尔效应
B.含0.1 mol FeCl3溶质的溶液形成胶体后,胶体粒子为0.1 mol
C.分散系中分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液
D.可通过观察液体是否澄清透明,来区别溶液和胶体
查看答案和解析>>
科目:高中化学 来源:2016届吉林省高一上学期期末质量检测化学试卷(解析版) 题型:选择题
(1)按要求写出化学式。
①石灰石的主要成分 ;②纯碱 ;
③漂白液的有效成分 ;④硅石的主要成分 。
(2)将下列7个反应分成两类:
①白色的Fe(OH)2先变成灰绿最后变成红褐色;
②NaOH腐蚀玻璃;
③铝屑溶于NaOH溶液;
④小苏打受热分解;
⑤NO2被水吸收;
⑥NH4Cl与熟石灰反应;
⑦高炉炼铁
第一类是 ;第二类是 。(填序号)
分类依据是 。
查看答案和解析>>
科目:高中化学 来源:2016届吉林省高一上学期期末质量检测化学试卷(解析版) 题型:选择题
海水淡化的研究已经有很长时间的历史了,通过海水淡化可以部分解决淡水紧缺的问题。下列可以实现海水淡化的实验操作是
A.过滤 B.蒸发 C.蒸馏 D. 萃取
查看答案和解析>>
科目:高中化学 来源:2016届云南省高一下学期第一次月考化学试卷(解析版) 题型:选择题
几种短周期元素的原子半径及主要化合价如下表:
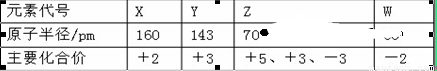
下列叙述正确的是 ( )
A.X、Y元素的金属性 X<Y
B.一定条件下,Z单质与W的常见单质直接生成ZW2
C.Y的最高价氧化物对应的水化物能溶于氨水
D.Z的气态氢化物与其最高价氧化物对应的水化物可以反应
查看答案和解析>>
科目:高中化学 来源:2016届云南省高一下学期第一次月考化学试卷(解析版) 题型:选择题
下列存在丁达尔现象的分散系是( )
①有尘埃的空气
②溴水
③蒸馏水
④沸水中加入适量饱和FeCl3的溶液至溶液变为透明的红褐色液体
⑤淀粉的溶液
A.①②③⑤ B.①④⑤ C.②③ D.②③⑤
查看答案和解析>>
科目:高中化学 来源:2015届福建省龙岩市高二第一学期教学质量检测化学试卷(解析版) 题型:填空题
KMnO4酸性溶液与草酸(H2C2O4)溶液反应时,溶液紫色会逐渐褪去。某探究小组用测定此反应溶液紫色消失所需时间的方法,研究外界条件对反应速率的影响。该实验条件作如下限定:
①所用KMnO4酸性溶液的浓度可选择:0.02 mol·L-1、0.002 mol·L-1;
②所用H2C2O4溶液的浓度可选择:0.2 mol·L-1、0.4 mol·L-1;
③每次实验时KMnO4酸性溶液的用量均为4 mL、H2C2O4溶液的用量均为2mL。
(1)若要探究反应物浓度、温度、催化剂对反应速率的影响,通过变换这些实验条件,至少需要完成____ 组实验进行对比即可得出结论。
(2)在其它条件相同的情况下,某同学改变KMnO4酸性溶液的浓度,测得实验数据(从混合振荡均匀开始计时)如下表所示:
KMnO4酸性溶液浓度 (mol·L-1) | 溶液褪色所需时间(min) | |||
第一次 | 第二次 | 第三次 | ||
0.02 | 14 | 13 | 11 | |
0.002 | 6.7 | 6.6 | 6.7 | |
①用0.002 mol/L KMnO4酸性溶液进行实验时,KMnO4的平均反应速率(忽略混合前后溶液体积变化)。
②依据表中数据,不能得出“溶液的褪色所需时间越短,反应速率越快”的结论。某同学设计以下方案,可以直接得出“褪色时间越短,反应的速率越快”结论。
KMnO4酸性溶液 | H2C2O4溶液 | ||
浓度/ mol/L | 体积(ml) | 浓度/ mol/L | 体积(ml) |
0.02 | 2 | b | 4 |
a | 2 | c | 4 |
则表中a= ;b= ;c= 。
(3)草酸电离常数:Ka1=5.9×10-2,Ka2=6.4×10-5。与KMnO4反应时,它将转化为CO2和H2O。
①草酸与酸性高锰酸钾溶液反应的离子方程式为 。
②室温下,0.1mol·L-1 KHC2O4酸溶液中pH 7,理由是 。
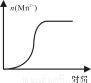
(4)测得某次实验(恒温)时溶液中Mn2+物质的量与时间关系如图。请解释n(Mn2+)在反应起始时变化不大、一段时间后快速增大的原因: 。
查看答案和解析>>
科目:高中化学 来源:2015届福建省龙岩市高二第一学期教学质量检测化学试卷(解析版) 题型:选择题
已知化学反应A2(g) + B2(g) = 2AB(g)的能量变化如图所示,下列叙述正确的是
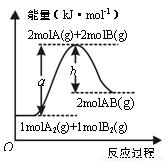
A.每生成2分子AB吸收bkJ热量
B.该反应热△H=(b -a)kJ·mol-1
C.反应物的总能量低于生成物的总能量
D.断裂1molA—A和1molB—B键,放出akJ能量
查看答案和解析>>
科目:高中化学 来源:2015届湖南省益阳市高二下学期第一次月考化学试卷(解析版) 题型:选择题
现有一瓶甲、乙的混合物,已知甲、乙属同系物,甲、乙某些性质如下:
物质 | 分子式 | 熔点(℃) | 沸点(℃) | 密度(g/cm3) | 水溶性 |
甲 | C3H6O2 | -98 | 55.5 | 0.93 | 可溶 |
乙 | C4H8O2 | -84 | 87 | 0.90 | 可溶 |
根据物理性质,将混合物中甲、乙分离的最佳方法是( )
A.蒸馏 B.萃取 C.重结晶 D.分液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com