
| A. | 铁与氯化铁溶液反应:Fe+Fe3+═2Fe2+ | |
| B. | 氢氧化钡溶液与硫酸反应:OHˉ+SO42-+Ba2++H+═H2O+BaSO4 | |
| C. | 二氧化硅与氢氧化钠溶液反应:SiO2+OHˉ═H2SiO3 | |
| D. | 碳酸钙与盐酸反应:CaCO3+2H+═Ca2++CO2↑+H2O |
分析 A.电子、电荷不守恒;
B.不符合离子的配比;
C.反应生成硅酸钠和水;
D.反应生成氯化钙、水、二氧化碳.
解答 解:A.铁与氯化铁溶液反应的离子反应为Fe+2Fe3+═3Fe2+,故A错误;
B.氢氧化钡溶液与硫酸反应的离子反应为2OH-+SO42-+Ba2++2H+═2H2O+BaSO4↓,故B错误;
C.二氧化硅与氢氧化钠溶液反应的离子反应为SiO2+2OH-═SiO32-+H2O,故C错误;
D.碳酸钙与盐酸反应的离子反应为CaCO3+2H+═Ca2++CO2↑+H2O,故D正确;
故选D.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重氧化还原反应、复分解反应的离子反应及分析与应用能力的考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.


 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:选择题
| A. | 一定浓度的醋酸钠溶液可使酚酞溶液变红,其原因是发生了如下反应:CH3COO-+H2O?CH3COOH+OH-,使得溶液中的c(OH-)>c(H+) | |
| B. | 在常温下,10 mL 0.2 mol•L-1盐酸与10 mL 0.2 mol•L-1 Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=13 | |
| C. | 在0.1 mol•L-1 NH4Cl溶液中:c(H+)+c(NH4+=c(Cl-) | |
| D. | 5 mL 1 mol•L-1 CH3COONa溶液与5 mL 1 mol•L-1盐酸混合液中c(Cl-)=c(Na+)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 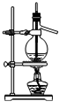 石油的分馏 | B. | 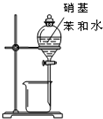 分离硝基苯和水 | ||
| C. | 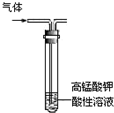 除去甲烷中的乙烯 | D. | 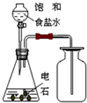 制取并收集乙炔气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸与氢氧化钡在溶液中反应Ba2++SO42-═BaSO4↓ | |
| B. | 氢氧化镁溶于稀硫酸:2H++Mg(OH)2═Mg2++2H2O | |
| C. | 大理石与盐酸反应 CO32-+2H+═H2O+CO2↑ | |
| D. | 少量金属钠投入到CuSO4溶液中 2Na+Cu2+═2Na++Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
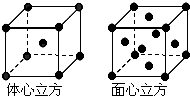 如下表是元素周期表中的前四周期,①~⑨为相应的元素,请从中选择合适的元素回答问题
如下表是元素周期表中的前四周期,①~⑨为相应的元素,请从中选择合适的元素回答问题 | ① | |||||||||||||||||
| ② | ③ | ④ | ⑤ | ⑥ | |||||||||||||
| ⑦ | ⑧ | ⑨ | |||||||||||||||
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{2}^{3}$He原子核内有2个中子 | |
| B. | ${\;}_{2}^{3}$He原子核外有3个电子 | |
| C. | ${\;}_{2}^{3}$He原子核内有3个质子 | |
| D. | ${\;}_{2}^{3}$He和${\;}_{2}^{4}$He是两种不同的核素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同分异构体: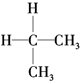 、 、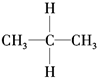 | B. | 烷烃:CH4、 、CH2═CH2 、CH2═CH2 | ||
| C. | 糖类:葡萄糖、蔗糖、纤维素 | D. | 有机高分子:塑料、橡胶、油脂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Ca2+、Cl-、SO42- | B. | NH4+、HCO3-、Cl-、K+ | ||
| C. | Cl-、Na+、NO3-、Ca2+ | D. | MnO4-、NO3-、Na+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知X、Y、Z、J、Q五种短周期主族元素,原子序数依次增大,元素Z在地壳中含量最高,J元素的焰色反应呈黄色,Q的最外层电子数与其电子总数比为3:8,X能与J形成离子化合物,且J+的半径大于X-的半径,Y2是空气主要成分之一.请回答:
已知X、Y、Z、J、Q五种短周期主族元素,原子序数依次增大,元素Z在地壳中含量最高,J元素的焰色反应呈黄色,Q的最外层电子数与其电子总数比为3:8,X能与J形成离子化合物,且J+的半径大于X-的半径,Y2是空气主要成分之一.请回答: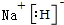
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com