
【题目】等质量的两种金属粉末A、B分别与同浓度的足量稀盐酸反应,都生成+2价金属氯化物,其反应情况如图所示:

(1) 两种金属的活动性顺序是_____>______
两种金属氯化物的摩尔质量是_____>______
(2) 将两种金属粉末按一定比例混合后,进行甲、乙
丙三组实验,三组实验各取500mL同浓度的盐酸
溶液加入该种混合粉末,产生气体,有关数据如下:
实验序号 | 甲 | 乙 | 丙 |
混合粉末质量(g) | 6.2 | 18.6 | 24.8 |
生成气体气体(mL) | 2240 | 5600 | 5600 |
①乙组实验中,盐酸________(填“过量”、“适量”或“不足量”)
②上述所用的盐酸的物质的量浓度为_____mol/L,混合粉末的平均摩尔质量是________。
【答案】B A B A 不足量 1 62g/mol
【解析】
(1)从图可知,B与盐酸的曲线的斜率要大,这个斜率就是反应的速率大小,所以两种金属的活动性顺序是B>A,等质量的A、B与同浓度的足量稀盐酸反应,A放出的氢气多(看最后平台对应的纵坐标),所以A的摩尔质量要小;
(2)①甲组实验,后面随着金属的量增加,放出的气体增加,故甲组是盐酸过量,乙组实验中,金属质量是甲组的3倍,如果金属全都反应完,产生的气体应该是甲组的3倍,而给出的数据是小于3倍,很明显乙组中的盐酸已经不足了;
②计算最终生成氢气的物质的量,根据H原子守恒计算n(HCl),进而计算c(HCl);甲组实验中金属完全反应,金属都为+2价,根据电子转移守恒,金属物质的量等于氢气物质的量,则金属的平均摩尔质量═![]() 。
。
(1)从图可知,B与盐酸的速率比A大,所以两种金属的活动性顺序是B>A,等质量的A、B与同浓度的足量稀盐酸反应,A放出的氢气多,所以A的摩尔质量要小,所以两种金属氯化物的摩尔质量是B>A;
(2)①甲组实验,随着金属的量增加,放出的气体增加,故甲组是盐酸过量,乙组实验中,金属质量是甲组的3倍,如果金属全都反应完,产生的气体应该是甲组的3倍,而给出的数据是小于3倍,乙组中的盐酸已经不足;
②最终生成氢气的物质的量为![]() =0.25mol,根据H原子守恒n(HCl)=0.25×2=0.5mol,所以c(HCl)=
=0.25mol,根据H原子守恒n(HCl)=0.25×2=0.5mol,所以c(HCl)= ![]() =1mol/L;甲组实验中金属完全反应,金属都为+2价,根据电子转移守恒,金属物质的量等于氢气物质的量,此时生成氢气为
=1mol/L;甲组实验中金属完全反应,金属都为+2价,根据电子转移守恒,金属物质的量等于氢气物质的量,此时生成氢气为![]() =0.1mol,故金属的平均摩尔质量═
=0.1mol,故金属的平均摩尔质量═![]() =62g/mol。
=62g/mol。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】现有KNO3样品(含有少量杂质KCl、K2SO4),选择适当的试剂除去杂质,从而得到纯净的KNO3晶体,相应的实验流程如图所示。
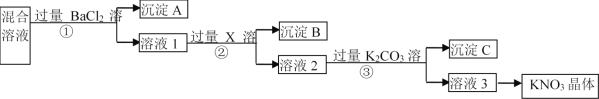
请回答下列问题:
(1)写出实验流程中下列物质的化学式:试剂X__,沉淀C__、__。
(2)上述实验流程中①②③步均要进行的实验操作是__(填操作名称)。
(3)生成沉淀A的离子方程式是__。
(4)此实验方案存在缺陷,还应__,之后若要获得纯净的KNO3晶体,需进行的实验操作是__、__(填操作名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍的单质、合金及其化合物用途非常广泛。
(1)Ni2+基态核外电子排布式为________。
(2)胶状镍可催化CH2=CHC≡N加氢生成CH3CH2C≡N。CH2=CHC≡N分子中σ键与π键的数目比n(σ)∶n(π)=________;CH3CH2C≡N分子中碳原子轨道的杂化类型为________。
(3)[Ni(N2H4)2](N3)2是一种富氮含能材料。配体N2H4能与水混溶,除因为它们都是极性分子外,还因为______________________;[Ni(N2H4)2]2+中含四个配位键,不考虑空间构型,[Ni(N2H4)2]2+的结构可用示意图表示为______________________。
(4)一种新型的功能材料的晶胞结构如下图所示,它的化学式可表示为________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是中国在南极建设的第四个科学考察站——泰山站。为了延长科学考察站基础设施使用寿命,钢铁设备表面镶嵌一些金属块(M)。下列说法正确的是

A. 金属块M可能是铜,发生氧化反应
B. 这种保护方法叫牺牲阳极的阴极保护法
C. 科考考察站里的设备在潮湿空气中主要发生化学腐蚀
D. 若采用外加电流的阴极保护法,设备与电源正极相连
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组对NH4NO3的热分解产物提出如下4种猜想:
甲:N2、HNO3、H2O 乙:N2O、NO、H2O
丙:NH3、N2、H2O 丁:N2、NO、H2O
你认为猜想有科学性不正确的是( )
A.甲和乙B.乙和丁C.乙和丙D.丙和丁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,所含分子数相同的是( )
A.10g H2 和10g O2B.9g H2O 和0.5mol Br2
C.5.6L N2(非标准状况)和11g CO2D.224mLH2 (标准状况)和0.1mol N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用湿法工艺从阳极泥(主要含有Cu、Ag、Au)中提取Ag、Au的流程如图所示:
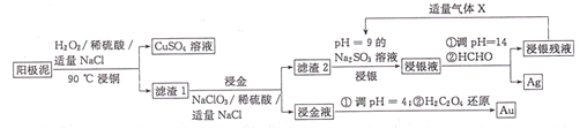
回答下列问题:
(1)“浸铜”时,铜参与反应的离子方程式为______________;若温度过高,铜的浸出率会降低,原因是______________。
(2)“浸金液”的主要成分是H[AuCl4],则“浸金”步骤发生反应的化学方程式为NaCl+NaClO3+Au+H2SO4→Na2SO4+H2O+H[AuCl4](未配平),该反应中氧化剂与还原剂物质的量之比为______________,“王水”也可溶解金,王水的成分为______________。
(3)从“浸金液”中提取金时氧化剂和还原剂的物质的量之比为______________。
(4)“浸银”时发生反应AgCl+2SO32-![]() Ag(SO3)23-+C1-,Ag(SO3)23-将HCHO氧化为CO32-。向“浸银残液”中通入气体X,可得到Na2SO3再生液,X的化学式为______________,Na2SO3再生液的循环使用次数与银的浸出率关系如图所示:
Ag(SO3)23-+C1-,Ag(SO3)23-将HCHO氧化为CO32-。向“浸银残液”中通入气体X,可得到Na2SO3再生液,X的化学式为______________,Na2SO3再生液的循环使用次数与银的浸出率关系如图所示:
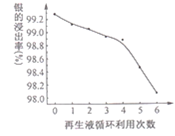
从平衡移动角度解释上述曲线的变化原因:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、现象和结论均正确,且存在对应关系的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 将NaOH溶液逐滴滴加到AlC13溶液中至过量 | 先产生白色胶状沉淀,后沉淀溶解 | Al(OH)3是两性氢氧化物 |
B | NaHCO3溶液与NaAlO溶液混合 | 生成白色沉淀 | 结合H+的能力:CO32->AlO2- |
C | 向盛有Na2SiO3,溶液的试管中滴加1滴酚酞,然后逐滴加入稀盐酸至过量 | 试管中红色逐渐褪去,出现白色凝胶 | 非金属性:Cl>Si |
D |
| 白色固体先变为淡黄色,后变为黄色 | 溶度积常数:Ksp(AgCl)>Ksp(AgBr)>Ksp(AgI) |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中:按CO2与H2的物质的量之比为1:3进行投料,发生反应2CO2(g)+6H2(g)![]() CH3CH2OH(g)+3H2O(g) △H<0,在5MPa 下测得不同温度下平衡体系中各种物质的体积分数 ( V% ) 如图所示,下列说法中正确的是
CH3CH2OH(g)+3H2O(g) △H<0,在5MPa 下测得不同温度下平衡体系中各种物质的体积分数 ( V% ) 如图所示,下列说法中正确的是
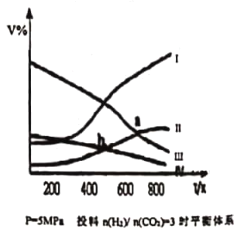
A.表示CH3CH2OH组分的曲线是IV
B.图中曲线交点a、b 对应的上述反应平衡常数Ka > Kb
C.图中曲线交点a 对应的 CO2 转化率为 40%
D.若甲、乙两个密闭容器起始时的容积、温度及投料方式均相同,甲:恒温恒压,乙;恒温恒容,反应达平衡时CH3CH2OH产率:甲<乙
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com