
����Ŀ��������Ԫ��W��X��Y��Z��ԭ�������������ӡ�m��p��r������ЩԪ����ɵĶ�Ԫ�����n��Ԫ��Z�ĵ��ʣ�ͨ��Ϊ����ɫ���壬q��ˮ��Һ����Ư���ԣ�0.01mol��L-1r��Һ��pHΪ2��sͨ����������ˮ�Ļ����������ʵ�ת����ϵ��ͼ��ʾ������˵����ȷ���ǣ� ��

A. ԭ�Ӱ뾶�Ĵ�СW <X<Y B. Ԫ�صķǽ�����Z>X>Y
C. Y���⻯�ﳣ�³�ѹ��ΪҺ̬ D. X������������ˮ����Ϊǿ��
���𰸡�C
����������n��Ԫ��Z�ĵ��ʣ�ͨ��Ϊ����ɫ���壬��֪ZԪ��ΪCl��nΪCl2���ٸ���q��ˮ��Һ����Ư���ԣ���֪qΪHClO����0.01 mol��L��1 r��Һ��pHΪ2�����ж�rΪһԪǿ�ᣬ��rΪHCl��Ȼ�����n��p�ķ�Ӧ�������Լ�sͨ����������ˮ�Ļ�����֪pΪ������sΪ�������ȴ���������⣬W��X��Y��Z�Ƕ�����ԭ�������������ӵ�����Ԫ�أ��ɽ�һ����֪W��X��Y��Z�ֱ�ΪH��C��O��Cl��A������ԭ�Ӱ뾶�ı仯���ɣ���֪ԭ�Ӱ뾶��H<O<C��ѡ��A����B������ͬ����Ԫ�طǽ����ı仯���ɣ���֪�ǽ����ԣ�O��C������CCl4��ClO2�л��ϼ۵���������֪�ǽ����ԣ�O��Cl��C��ѡ��B����C�������⻯�����ΪH2O��H2O2�����³�ѹ�¶��߾�ΪҺ̬��ѡ��C��ȷ��D��̼������������ˮ����H2CO3Ϊ���ᣬѡ��D����ѡC��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����MgCl2��Al2(SO4)3�Ļ����Һ�в��ϼ���NaOH��Һ���õ����������ʵ��������NaOH��Һ����Ĺ�ϵ��ͼ��ʾ����ԭ��Һ��Mg2+��Al3+�����ʵ���֮���ǣ� ��

A. 1��2 B. 1��1 C. 2��3 D. 3��2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڻ�ѧ�����У�������KMnO4����Һ������KMnO4�����������²�̫�ȶ����������ֱ������ȷ���ʵ���Ũ�ȵ�KMnO4��Һ��ʵ����һ���ȳ�ȡһ��������KMnO4���壬��ɴ���Ũ�ȵ�KMnO4��Һ�����������ȶ�����Է��������ϴ�Ļ����ʲ����ƣ������Ƶ�KMnO4��Һ���б궨����������Ƶ�KMnO4��Һ��ȷŨ�ȣ���Ӧԭ��Ϊ��5C2O42��+2MnO4��+16H+=10CO2��+2Mn2++8H2O
�����DZ궨KMnO4��Һ��ʵ�鲽�裺
����һ���ȴ���Ũ��ԼΪ0.1molL��1�ĸ��������Һ500mL��
�������ȡ0.2000molL��1��Na2C2O420.00mL������ƿ�У�����ϡ�����ữ���ò���һ������������Һ���еζ�������ƽ��ʵ������ݼ�¼�ڱ��У�
ƽ��ʵ���� | Na2C2O4��Һ��mL�� | �ζ�����ʼ������mL�� | �ζ��ܵζ��յ������mL�� |
1 | 20.00 | 0.00 | 23.18 |
2 | 20.00 | 1.02 | 21.00 |
3 | 20.00 | 1.18 | 21.20 |
�Իش��������⣺
��1������һ�д�����ҺҪ�õ�����Ҫ������������Ͳ����� ��
��2�����������ҺӦʢװ�������ʽ����ʽ�����ζ����У���ʹ�õζ���ǰ��Ӧ������λ���ƣ��Ƿ�©ˮ����ȷ���ζ��ܲ�©ˮ��ʹ�ã���ϴ�ζ����ڱں��Һ��Ӧ�ӵζ��ܵ�����²����롱���Ͽڵ��롱��Ԥ�õ��ձ��У�������еζ��յ���жϷ����ǣ� ��
��3�����еζ������ᵼ�²������ƫ�ߵ��� ��
A.�ζ��ܵζ�ǰ�����ݣ��ζ���������ʧ
B.��ƿϴ�Ӻ�û�и���
C.�ζ��յ����ʱ����
D.�ζ�ʱ��ƿ����Һ�彦��
��4����ʵ���������ݼ��㣬KMnO4��Һ��Ũ��ΪmolL��1 ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������Һ�е� Cl-����Ca2+��Mg2+��SO42-����������Լ��У�
A. Ba(NO3)2 B. BaCl2 C. Na2CO3 D. AgNO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��������Ϊ�������Դ�����ʼ��ٻ�����Ⱦ�����ѳ����ȼ�ͼ״�����ɲ�ҵ��������Ҫ�������£�
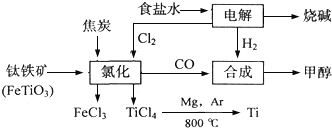
��1��д�����ʳ��ˮ��Ӧ�����ӷ���ʽ________________________________��������ÿ���ɱ�״���µ�11.2L���壬ת�Ƶ��ӵ����ʵ�����_______
��2��д���������Ȼ����õ����Ȼ��ѵĻ�ѧ����ʽ��____________________��
��3����Ӧ2Mg+TiCl4![]() 2MgCl4+Ti��Ar�����н��е�������__________��
2MgCl4+Ti��Ar������������__________��
��4����������ҵ���У��ϳ�192t�״�����������ⲹ��H2_______t���������������������ʵ��κ���ʧ����
��5���Լ״�������������������ҺΪԭ�ϣ�ʯīΪ�缫�ɹ���ȼ�ϵ�أ��õ���и����ϵĵ缫��Ӧʽ��___________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��J��L��M��R��T��ԭ��������������Ķ���������Ԫ�أ�J��R�����ڱ��е����λ�������JԪ��������ϼ۵ľ���ֵ����ԭ��������������ȣ�M�ǵؿ��к������Ľ���Ԫ�ء�
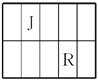
(1)M�����ӽṹʾ��ͼΪ________��Ԫ��T�����ڱ���λ�ڵ�________�塣
(2)J������ɵĻ����������6��ԭ�ӣ���ṹ��ʽΪ_____________________��
(3)M��T�γɵĻ������ڳ�ʪ�Ŀ�����ð��ɫ��������Ӧ�Ļ�ѧ����ʽΪ________________________________________________________________________��
(4)L�������̬�⻯���ˮ��Һ�Լ��ԡ������ӹ�ҵ�У���ˮ��Һ������ʴ��H2O2�����������������Ӧ�IJ��ﲻ��Ⱦ�������仯ѧ����ʽΪ____________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼʾ���Ӧ�������������
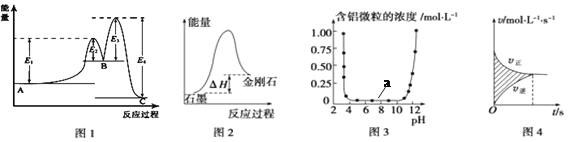
A. ͼ1��ʾ��A��C��Ӧ����H =E1-E2
B. ͼ2��ʾ�����ʯ��ʯī�ȶ�
C. ͼ3��ʾ����Al3+��OH-��Ӧʱ������Ũ�ȱ仯���ߣ�ͼ��a�����������Al(OH)3
D. ͼ4��ʾ��ͼ����Ӱ��������ĺ����ǣ�����-������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����·��������ڹ�ҵұ����������
A.�������AlCl3��ȡ������B.���MgCl2��Һ��ȡ����þ
C.��CO��ԭ����ʯ����ȡ������D.��ⱥ��ʳ��ˮ����ȡ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com