
| | 实验操作 | 现象 | 结论 |
| A | 某有机物与溴的四氯化碳溶液混合 | 溶液褪色 | 有机物含碳碳双键 |
| B | 乙醇与重铬酸钾(K2Cr2O7)溶液混合 | 橙色溶液变为绿色 | 乙醇具有还原性 |
| C | 常温下,将二氧化碳通入苯酚钠溶液 | 溶液变浑浊 | 酸性:碳酸>苯酚 |
| D | 苯和苯酚稀溶液分别与浓溴水混合 | 后者产生白色沉淀 | 羟基影响了苯环的活性 |
科目:高中化学 来源:不详 题型:单选题
| 编号 | A | B | C | D |
| 实验 方案 |  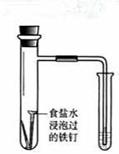 食盐水 | 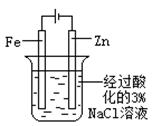 片刻后在Fe电极附近滴入K3[Fe(CN)6]溶液 | 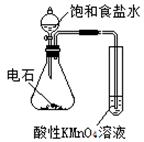 | 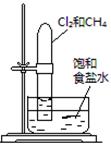 置于光亮处 |
| 实验 目的 | 验证铁钉发生 析氢腐蚀 | 验证Fe电极被保护 | 验证乙炔的还原性 | 验证甲烷与氯气发生 化学反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
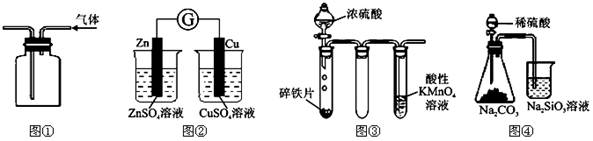
| A.用图①所示实验装置排空气法收集H2气体 |
| B.图②装置可以用来验证化学能转化为电能 |
| C.图③铁片最终完全溶解,且高锰酸钾溶液褪色 |
| D.图④所示实验可比较硫、碳、硅三种元素的非金属性强弱 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 代号 | 实 验 | 实验目的 |
| A | Cl2、Br2分别与H2反应 | 比较氯与溴的非金属性强弱 |
| B | 同温下测定相同浓度的Na2CO3, 和Na2SO4溶液的酸碱性 | 比较硫酸与碳酸的酸性强弱 |
| C | AlCl3、MgCl2溶液中通人过量氨气 | 比较镁与铝单质的还原性强弱 |
| D | 同温下用同一电路分别测定同浓度的 盐酸和某一元酸溶液导电能力 | 比较该一元酸与盐酸酸性的强弱 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.一定没有N2,CO和HCl中至少有一种 |
| B.一定有N2、HCl和CO |
| C.一定有N2,CO和HCl中至少有一种 |
| D.一定有N2和HCl,没有CO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com