
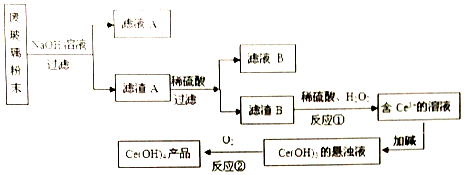
分析 废玻璃粉末(含SiO2、Fe2O3、CeO2、FeO等物质)加氢氧化钠溶液,二氧化硅溶于氢氧化钠生成硅酸钠,Fe2O3、CeO2、FeO不溶,过滤,得到滤液A的主要成分为硅酸钠,滤渣A的成分是Fe2O3、CeO2、FeO,滤渣A(Fe2O3、CeO2、FeO)加稀硫酸后过滤得滤液B是硫酸亚铁、硫酸铁的混合溶液,滤渣B的成分是CeO2,CeO2与H2O2和稀H2SO4反应生成Ce3+和O2,反应为:2CeO2+H2O2+6H+=2Ce3++O2↑+4H2O;Ce3+加碱生成Ce(OH)3悬浊液;Ce(OH)3悬浊液被氧化生成Ce(OH)4,据此分析解答.
解答 解:(1)废玻璃粉末加氢氧化钠溶液,二氧化硅溶于氢氧化钠生成硅酸钠,Fe2O3、CeO2、FeO不溶,过滤,得到滤液A的主要成分为硅酸钠,滤渣A的成分是Fe2O3、CeO2、FeO,加稀硫酸后过滤得滤液B主要成分为额是硫酸亚铁、硫酸铁的混合溶液;
故答案为:Na2SiO3;Fe2+、Fe3+;
(2)反应①为CeO2与H2O2和稀H2SO4反应生成Ce3+和O2,反应为:2CeO2+H2O2+6H+=2Ce3++O2↑+4H2O;
故答案为:2CeO2+H2O2+6H+=2Ce3++O2↑+4H2O;
(3)反应①之前要洗涤滤渣B,方法为:沿玻璃棒向漏斗中加蒸馏水至没过沉淀,待水自然流下,重复2~3次;
故答案为:沿玻璃棒向漏斗中加蒸馏水至没过沉淀,待水自然流下,重复2~3次;
(4)反应②为Ce(OH)3悬浊液被氧化生成Ce(OH)4,反应为:4Ce(OH)3+O2+4H2O=4Ce(OH)4;
故答案为:4Ce(OH)3+O2+4H2O=4Ce(OH)4;
(5)分液用到的仪器为分液漏斗;加入硫酸,可使平衡向左进行,使Ce3+进入水层,所以可选择硫酸作反萃取剂;
故答案为:分液漏斗;加入硫酸,可使平衡向左进行,使Ce3+进入水层;
(6)所用FeSO4溶液在空气中露置一段时间后再进行滴定,部分亚铁离子被氧化生成铁离子,则硫酸亚铁浓度降低,导致硫酸亚铁溶液体积增大,所以测得该Ce(OH)4产品的质量分数偏大;
故答案为:偏大.
点评 本题考查物质分离和提纯,为高频考点,涉及物质分离和提纯方法选取、氧化还原反应等知识点,明确反应原理是解本题关键,知道流程图中发生的反应及基本操作方法,题目难度中等.


科目:高中化学 来源: 题型:选择题
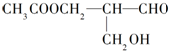 在有机物分子中,若某个碳原子连接着四个不同的原子或原子团,这种碳原子称为“手性碳原子”.凡有一个手性碳原子的物质一定具有光学活性,下面的物质有光学活性:发生下列反应后生成的有机物无光学活性的是( )
在有机物分子中,若某个碳原子连接着四个不同的原子或原子团,这种碳原子称为“手性碳原子”.凡有一个手性碳原子的物质一定具有光学活性,下面的物质有光学活性:发生下列反应后生成的有机物无光学活性的是( )| A. | 与甲酸发生酯化反应 | B. | 与新制的氢氧化铜作用 | ||
| C. | 与银氨溶液作用 | D. | 在催化剂存在下与H2作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KI被氧化成KOH | |
| B. | KI是离子化合物,I2是共价化合物 | |
| C. | 1 mol O3 在反应中得到4 mol 电子 | |
| D. | KOH中既有离子键又有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
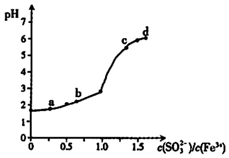 向FeCl3溶液中加入Na2SO3溶液,测定混合后溶液pH随混合前溶液中$\frac{c(S{O}_{3}^{2-})}{c(F{e}^{3+})}$变化的曲线如图所示.实验发现:
向FeCl3溶液中加入Na2SO3溶液,测定混合后溶液pH随混合前溶液中$\frac{c(S{O}_{3}^{2-})}{c(F{e}^{3+})}$变化的曲线如图所示.实验发现:| A. | 向a点溶液中滴加BaCl2溶液,无明显现象 | |
| B. | b点较a点溶液pH升高的主要原因:2Fe3++SO32-+H2O═2Fe2++SO42-+2H+ | |
| C. | c点溶液中发生的主要反应:2Fe3++3SO32-+6H2O?2Fe( OH)3+3H2SO3 | |
| D. | 向d点上层清液中滴加KSCN溶液,溶液变红;再滴加NaOH溶液,红色加深 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲苯、氯乙烯、苯乙炔分子内所有原子一定在同一平面上 | |
| B. | 苯、乙烯、聚乙烯都能发生加成反应,也能发生氧化反应 | |
| C. | 等质量的乙烯和乙醇完全燃烧,消耗氧气的物质的量相等 | |
| D. | 分子式为C5H10O2,能发生水解反应但不能发生银镜反应的有机物有5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在T°C时,某溶液中c(H+)=$\sqrt{{K}_{W}}$,则该溶液一定显中性 | |
| B. | 25°C时,如弱酸与强碱溶液的pH之和等于14,则它们等体积混合液呈酸性 | |
| C. | 常温下,pH相等的NaOH溶液与氨水稀释后保持pH仍然相等,则氨水加水多 | |
| D. | 体积和pH均相等的HCl与CH3COOH溶液分别与足量锌粒反应,放出H2一样多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化石燃料是可再生能源 | B. | 风能、太阳能是清洁能源 | ||
| C. | 化石燃料都是清洁能源 | D. | 氢能是不可再生的清洁能源 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com