
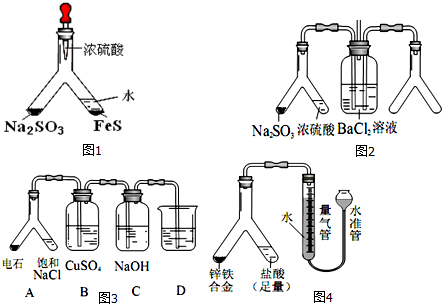
分析 (1)加入硫酸分别生成SO2和H2S,二者可发生反应生成S,H2S可与浓硫酸发生氧化还原反应;
(2)SO2与BaCl2反应产生沉淀,溶液中必须存在大量的SO32-;
(3)A中碳化钙与水反应生成乙炔,混有的硫化氢与硫酸铜反应生成CuS沉淀,NaOH与硫化氢发生中和反应,D中试剂检验乙炔;
(4)①读取量气管中数据时,为减小误差,应使水准管、量气管内液面相平;
②假设合金中Fe为xmol,Zn为ymol,列方程式组可解答该题.
解答 解:(1)加入硫酸分别生成SO2和H2S,二者可发生反应生成S,为淡黄色固体,H2S具有强还原性,可与浓硫酸发生氧化还原反应,所以与有FeS的一侧应用水稀释,
故答案为:管壁内有淡黄色固体生成;稀释浓硫酸,防止硫化氢被氧化;
(2)SO2与BaCl2反应产生沉淀,溶液中必须存在大量的SO32-,右侧Y型管中应能生成碱性气体或氧化性气体,如是碱性气体,溶液中存在大量的SO32-,如是氧化性气体,溶液中可生成SO42-,则生成的沉淀可能为BaSO3或BaSO4,
故答案为:浓氨水;碱石灰(固体 NaOH、生石灰);BaSO3[或BaSO4(合理即可)];
(3)①装置 A中发生的主要化学反应方程式为CaC2+2H2O→Ca(OH)2+CH≡CH↑,故答案为:CaC2+2H2O→Ca(OH)2+CH≡CH↑;
②B装置中出现黑色沉淀,C 装置的作用为,故答案为:除去 H2S;
③为验证电石气的主要成分,D中盛放KMnO4溶液 或 溴水 或 溴的CCl4溶液,故答案为:KMnO4溶液 或 溴水 或 溴的CCl4溶液;
(4)①读取量气管中数据时,为减小误差,应使水准管、量气管内液面相平,
故答案为:抬高(或移动)水准管位置,使水准管、量气管内液面相平;
②设合金中Fe为xmol,Zn为ymol,则有$\left\{\begin{array}{l}{56x+65y=0.117}\\{x+y=\frac{0.0448L}{22.4L/mol}}\end{array}\right.$
解之得:x=0.001444,y=0.000556,
则合金中铁的含量为$\frac{0.001444mol×56g/mol}{0.117g}$×100%=69.14%,
故答案为:69.14%.
点评 本题考查性质实验设计以及物质的含量的测定,为高频考点,本题注意根据物质的性质判断实验设计,侧重分析与实验、计算能力的综合考查,题目难度中等.


 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源: 题型:选择题
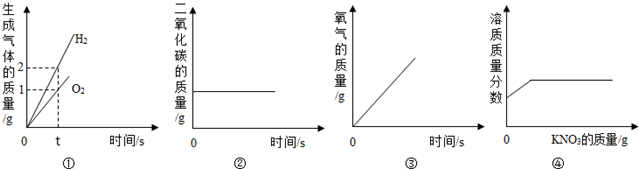
| A. | ①水的电解 | |
| B. | ②木炭在密闭的容器内燃烧 | |
| C. | ③加热一定量的高锰酸钾制氧气 | |
| D. | ④20℃时,向一定量接近饱和的硝酸钾溶液中加入硝酸钾固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | H2(g) | CO2(g) | CH2=CH2(g) | H2O(g) |
| 能量/kJ•mol-1 | 0 | -394 | 52 | -242 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定次数 | 待测液体积(mL) | HCl溶液体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 10.00 | 0.50 | 20.51 |
| 第二次 | 10.00 | 4.00 | 24.00 |
| 第三次 | 10.00 | 5.11 | 25.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
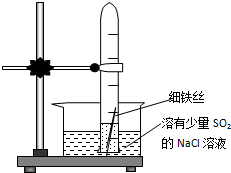 有一研究性学习小组在探究有关钢铁的腐蚀情况,他们进行了如下实验:在一个水槽中盛装1000mL水,加入一定量的NaCl固体溶解后通入SO2气体至溶液pH值约为4左右,另取一支试管(带刻度,规格50mL),一条约5cm 的细铁丝,将铁丝放入试管中,加入约10mL前面配好的溶液,迅速用拇指扣住试管口倒扣于水槽中,用铁架台将试管固定,如图.过一会儿:
有一研究性学习小组在探究有关钢铁的腐蚀情况,他们进行了如下实验:在一个水槽中盛装1000mL水,加入一定量的NaCl固体溶解后通入SO2气体至溶液pH值约为4左右,另取一支试管(带刻度,规格50mL),一条约5cm 的细铁丝,将铁丝放入试管中,加入约10mL前面配好的溶液,迅速用拇指扣住试管口倒扣于水槽中,用铁架台将试管固定,如图.过一会儿:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaO2(过氧化钡)固体中的阴离子和阳离子之比为2:1 | |
| B. | 在SiO2晶体中,1个Si原子和2个O原子形成2个共价键 | |
| C. | HCl的相对分子质量大于HF,所以HCl的沸点高于HF | |
| D. | 由ⅠA族和ⅥA族元素可形成原子个数比为1:1、电子总数为38的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0 mol•L-1 KNO3溶液:H+、Fe2+、SCN-、SO42- | |
| B. | 水电离出的c(H+)=10-10 mol•L-1的溶液:K+、Ba2+、NO3-、Cl- | |
| C. | pH=0的溶液:Al3+、Ag(NH3)2+、Cl-、SO42- | |
| D. | c(ClO-)=1.0 mol•L-1的溶液:Na+、SO32-、S2-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| ⅠA | Ⅷ | ||||||
| ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| ② | ③ | ④ | ⑧ | ||||
| ⑤ | ⑥ | ⑦ | ⑨ | ||||
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com