
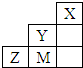
| A. | 非金属性:Y>M>Z | |
| B. | Y、Z、M的氢化物分子各原子最外层均满足8e-稳定结构 | |
| C. | 原子半径:M>Z>Y | |
| D. | Y 的最高价氧化物的水化物的化学式为HYO4 |
分析 由元素在短周期中的位置可知,X为He、Y为F、M为Cl、Z为S.
A.同周期自左而右非金属性最强,同主族自上而下非金属性减弱;
B.分子中H原子满足2电子稳定结构;
C.同周期自左而右原子半径减小、同主族自上而下原子半径增大;
D.F元素没有最高价含氧酸.
解答 解:由元素在短周期中的位置可知,X为He、Y为F、M为Cl、Z为S.
A.同周期自左而右非金属性最强,同主族自上而下非金属性减弱,故非金属性:Y>M>Z,故A正确;
B.分子中H原子满足2电子稳定结构,不满足8e-稳定结构,故B错误;
C.同周期自左而右原子半径减小、同主族自上而下原子半径增大,故原子半径:Z>M>Y,故C错误;
D.F元素没有最高价含氧酸,故D错误,
故选A.
点评 本题考查元素周期表与元素周期律,难度不大,注意对元素周期律的理解掌握.


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:选择题
| A. | D元素处于元素周期表中第3周期第Ⅳ族 | |
| B. | 四种元素的原子半径:A<B<C<D | |
| C. | B、D的最高价氧化物中,B、D与氧原子之间均为单键相连 | |
| D. | 一定条件下,B单质能置换出D单质,C单质能置换出A单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 电池负极反应为:Zn-2e-═Zn2+ | B. | 锌是负极,碳棒是正极 | ||
| C. | 电子由碳棒经外电路流向锌 | D. | 锌锰干电池属一次电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下反应4Fe(OH)2(s)+2H2O(l)+O2(g)═4Fe(OH)3(s)的△H>0,△S<0 | |
| B. | 500℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应,放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g)$?_{500℃、30MPa}^{催化剂}$2NH3(g),△H=-38.6 kJ•mol-1 | |
| C. | FeCl3溶液中通入SO2,溶液黄色褪去:2Fe3++SO2+2H2O═2Fe2++SO42-+4H+ | |
| D. | 向苯酚钠溶液中通入CO2,溶液变浑浊:2C6H5O-+CO2+H2O-→2C6H5OH↓+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
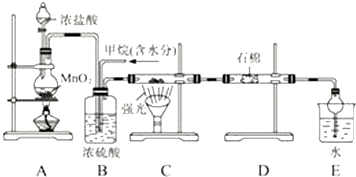
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
| 2 | ① | |||||||
| 3 | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
| 4 | ⑨ | ⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
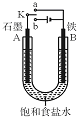 某课外活动小组同学用如图装置进行实验,试回答下列问题.
某课外活动小组同学用如图装置进行实验,试回答下列问题.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com