
 五种短周期元素在周期表中的相对位置如图所示,其中Z元素原子核外电子总数是其最外层电子数的3倍.
五种短周期元素在周期表中的相对位置如图所示,其中Z元素原子核外电子总数是其最外层电子数的3倍.

 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、化学反应中一定有化学键断裂,同时也有化学键形成 |
| B、含有共价键的化合物必是共价化合物 |
| C、含有阴离子的化合物一定含有阳离子 |
| D、金属元素和非金属元素形成的化合物不一定是离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向鸡蛋白溶液中缓慢加入饱和硫酸铵溶液析出沉淀 |
| B、将饱和氯化铁溶液滴入沸水中,得到红褐色液体 |
| C、向鸡蛋白溶液中加入硫酸铜溶液有沉淀析出 |
| D、液态植物油变固态脂肪 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、A一定形成+1价的阳离子 |
| B、B一定形成-2价单核阴离子 |
| C、Z一定能与水反应产生B单质 |
| D、Z一定是A2B型化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
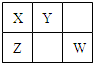 已知X、Y、Z、W四种短周期主族元素在周期表中的相对位置如图,其中X原子最外层电子数是其电子层数的2倍.下列说法正确的是( )
已知X、Y、Z、W四种短周期主族元素在周期表中的相对位置如图,其中X原子最外层电子数是其电子层数的2倍.下列说法正确的是( )| A、四种元素的原子半径大小rY>rW>rX>rZ |
| B、元素X的含氧酸只有一种,元素Y则有两种 |
| C、元素Z的气态氢化物的稳定性比元素Y的强 |
| D、元素Y和W的氧化物是导致酸雨的主要原因 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、恒容通入惰性气体 |
| B、恒压时通入惰性气体 |
| C、增加CO的浓度 |
| D、加催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com