
| A. | 乙醚的沸点 | B. | 乙醇在水中的溶解度 | ||
| C. | 氢化镁的晶格能 | D. | DNA的双螺旋结构 |
分析 氢键是分子间作用力的一种,F、O、N的电负性较强,对应的氢化物分子之间能形成氢键,氢键的存在,多数物质的物理性质有显著的影响,如熔点、沸点,溶解度,粘度,密度等,存在氢键的物质,水溶性显著增强,分子间作用力增强,熔沸点升高或降低,以此解答该题.
解答 解:A.乙醚分子间不存在氢键,乙醚的沸点与氢键无关,故A选;
B.乙醇和水分子间能形成氢键,乙醇在水中的溶解度与氢键有关,故B不选;
C.氢化镁为离子化合物,氢化镁的晶格能与氢键无关,故C选;
D.DNA含有O-H、N-H键,双螺旋结构与氢键有关,故D不选.
故选AC.
点评 本题为2015年海南考题第19题,侧重于氢键的考查,为高频考点,注意把握氢键的形成以及对物质的性质的影响,把握氢键与化学键、分子间作用了的区别,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
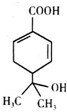
| A. | 分子式为C10H13O3 | |
| B. | 含有两种官能团,可使溴水和酸性高锰酸钾溶液褪色 | |
| C. | 能发生加成、取代、氧化等反应 | |
| D. | 与钠和氢氧化钠溶液都能发生反应,且得到的产物相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸溶液的pH=a,将此溶液稀释1倍后,溶液的pH=b,则a>b | |
| B. | pH=12的NaOH溶液和pH=2的CH3COOH溶液等体积混合,混合后溶液pH>7 | |
| C. | 物质的量浓度均为0.01 mol•L-1的CH3COOH和CH3COONa溶液等体积混合:c(CH3COOH)+c(CH3COO-)=0.01mol•L-1 | |
| D. | 能使石蕊试液变红的溶液中,Fe2+、Na+、NO3-、Cl-能大量存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 稀盐酸可除去烧瓶内残留的MnO2 | B. | 可用磨口玻璃瓶保存NaOH溶液 | ||
| C. | 稀硝酸可除去试管内壁的银镜 | D. | 煮沸自来水可除去其中的Ca(HCO3)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 银是一种贵金属,古代常用于制造钱币及装饰器皿,现代在电池和照相器材等领域亦有广泛应用.回答下列问题:
银是一种贵金属,古代常用于制造钱币及装饰器皿,现代在电池和照相器材等领域亦有广泛应用.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在溶液中加KSCN,溶液显红色,证明原溶液中有Fe3+,无Fe2+ | |
| B. | 气体通过无水CuSO4,粉末变蓝,证明原气体中含有水蒸气 | |
| C. | 灼烧白色粉末,火焰呈黄色,证明原粉末中有Na+,无K+ | |
| D. | 将气体通入澄清石灰水,溶液变浑浊,证明原气体是CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 FeCl3具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小,请回答下列问题:
FeCl3具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室以苯甲醛为原料制备间溴苯甲醛(实验装置见图,相关物质的沸点见附表).其实验步骤为:
实验室以苯甲醛为原料制备间溴苯甲醛(实验装置见图,相关物质的沸点见附表).其实验步骤为:| 物质 | 沸点/℃ | 物质 | 沸点/℃ |
| 溴 | 58.8 | 1,2-二氯乙烷 | 83.5 |
| 苯甲醛 | 179 | 间溴苯甲醛 | 229 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用厨房垃圾发酵制沼气属于物理变化 | |
| B. | 可用水作镁铝合金爆炸时的灭火剂 | |
| C. | 推广使用煤液化技术科减少温室气体二氧化碳的排放 | |
| D. | 超导材料K3C60在熔融状态下能够导电,说明K3C60是电解质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com