
| A、pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+c(H+)=c(OH-)+c(HC2O4-) |
| B、NaHSO4 溶液:c(H+)=c(SO42-)+c(OH-) |
| C、pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中c(Cl-)>c(H+)>c(NH4+ )>c(OH-) |
| D、Na2S溶液:c(Na+ )=2c(HS-)+2c(S2-)>2c(H2S) |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| 1.0 | 2.0 | 3.0 | |
| 810 | 54.0 | - | a |
| 915 | - | 75.0 | - |
| 1000 | - | b | 83.0 |
| A、△S<0 |
| B、915℃2.0MPa,A的转化率为60% |
| C、a>b |
| D、平衡常数:K(1000℃)<K(810℃) |
查看答案和解析>>
科目:高中化学 来源: 题型:
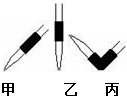 实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:请完成下列填空:
实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:请完成下列填空:| 实验编号 | NaOH溶液的浓度 (mol/L) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸溶液的体积 (mL) |
| 1 | 0.10 | 23.54 | 20.00 |
| 2 | 0.10 | 23.96 | 20.00 |
| 3 | 0.10 | 24.00 | 20.00 |
| 4 | 0.10 | 24.04 | 20.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
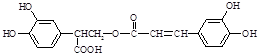
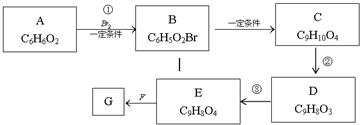
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
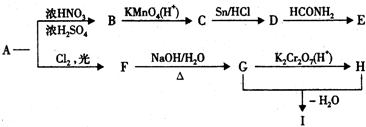
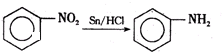

 ,物质E含2个六元环.
,物质E含2个六元环.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、小于7 | B、大于7 |
| C、小于或等于7 | D、大于7或等于7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com