
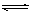 H2O(g)+CO(g)µÄĘ½ŗā³£Źż
H2O(g)+CO(g)µÄĘ½ŗā³£Źż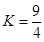 ”£øĆĪĀ¶ČĻĀŌŚĢå»ż¾łĪŖ10 LµÄČżøöĆܱÕČŻĘ÷ÖŠ·Ö±š¼ÓČė·“Ó¦Īļ£¬ĘšŹ¼¼ÓČėĮæČēĻĀĶ¼ĖłŹ¾£ŗ
”£øĆĪĀ¶ČĻĀŌŚĢå»ż¾łĪŖ10 LµÄČżøöĆܱÕČŻĘ÷ÖŠ·Ö±š¼ÓČė·“Ó¦Īļ£¬ĘšŹ¼¼ÓČėĮæČēĻĀĶ¼ĖłŹ¾£ŗ| ĘšŹ¼Įæ | ¼× | ŅŅ | ±ū |
| H2 £Ømol£© | 1 | 2 | 2 |
| CO2£Ømol£© | 1 | 1 | 2 |
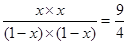 £¬½āµĆx£½0.6£¬¼“×Ŗ»ÆĀŹŹĒ60£„£¬BÕżČ·”£ŅŅĻąµ±ÓŚŌŚ¼×µÄ»ł“”ÉĻ×ī“óĒāĘųÅØ¶Č£¬æÉŅŌĢįøßCO2µÄ×Ŗ»ÆĀŹ£¬µ«ĒāĘų×Ŗ»ÆĀŹ½µµĶ£¬C²»ÕżČ·”£Ę½ŗāŹ±±ūÖŠĒāĘųŹĒ2mol£2mol”Į0.6£½0.8mol£¬ĖłŅŌÅØ¶ČŹĒ0.08mol/L£¬DÕżČ·£¬“š°øŃ”C”£
£¬½āµĆx£½0.6£¬¼“×Ŗ»ÆĀŹŹĒ60£„£¬BÕżČ·”£ŅŅĻąµ±ÓŚŌŚ¼×µÄ»ł“”ÉĻ×ī“óĒāĘųÅØ¶Č£¬æÉŅŌĢįøßCO2µÄ×Ŗ»ÆĀŹ£¬µ«ĒāĘų×Ŗ»ÆĀŹ½µµĶ£¬C²»ÕżČ·”£Ę½ŗāŹ±±ūÖŠĒāĘųŹĒ2mol£2mol”Į0.6£½0.8mol£¬ĖłŅŌÅØ¶ČŹĒ0.08mol/L£¬DÕżČ·£¬“š°øŃ”C”£


| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
A£®2NO2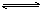 N2O4 (Õż·“Ó¦·ÅČČ) N2O4 (Õż·“Ó¦·ÅČČ) |
B£®NH4HCO3(s) 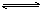 NH3+H2O (g)+CO2(Õż·“Ó¦ĪüČČ) NH3+H2O (g)+CO2(Õż·“Ó¦ĪüČČ) |
C£®H2(g)+I2(g)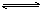 2HI(g) (Õż·“Ó¦·ÅČČ) 2HI(g) (Õż·“Ó¦·ÅČČ) |
D£®3O2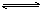 2O3£ØÕż·“Ó¦ĪŖĪüČČ·“Ó¦£© 2O3£ØÕż·“Ó¦ĪŖĪüČČ·“Ó¦£© |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
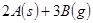

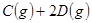 ”÷H
”÷H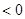 £¬ŌŚŅ»¶ØĢõ¼žĻĀ“ļµ½Ę½ŗā£¬ĻĀĮŠÓŠ¹ŲŠšŹöÕżČ·µÄŹĒ
£¬ŌŚŅ»¶ØĢõ¼žĻĀ“ļµ½Ę½ŗā£¬ĻĀĮŠÓŠ¹ŲŠšŹöÕżČ·µÄŹĒ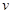 £ØÕż£©¼õŠ”£»¢ŪŃ¹ĒæŌö“óŅ»±¶£¬Ę½ŗā²»ŅĘ¶Æ£¬
£ØÕż£©¼õŠ”£»¢ŪŃ¹ĒæŌö“óŅ»±¶£¬Ę½ŗā²»ŅĘ¶Æ£¬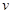 £ØÕż£©”¢
£ØÕż£©”¢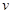 £ØÄę£©²»±ä£»¢ÜŌö“óBµÄÅØ¶Č£¬
£ØÄę£©²»±ä£»¢ÜŌö“óBµÄÅØ¶Č£¬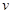 £ØÕż£©
£ØÕż£©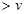 £ØÄę£©£»¢Ż¼ÓČė“߻ƼĮ£¬BµÄ×Ŗ»ÆĀŹĢįøß
£ØÄę£©£»¢Ż¼ÓČė“߻ƼĮ£¬BµÄ×Ŗ»ÆĀŹĢįøß| A£®¢Ł¢Ś | B£®¢Ū | C£®¢Ü | D£®¢Ü¢Ż |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
 CO2£Øg£©+H2(g)£¬ŅŃÖŖCOŗĶH2O£Øg£©µÄ³õŹ¼ÅضČĪŖ0.01mol”¤L-1Ź±£¬H2Ę½ŗāÅضČĪŖ0.005mol”¤L-1”£Čō“ĖŹ±ŌŁ¼ÓČė0.02mol”¤L-1µÄH2O£Øg£©£¬ÖŲŠĀ“ļµ½Ę½ŗāŹ±£¬H2Ę½ŗāÅضČĪŖ
CO2£Øg£©+H2(g)£¬ŅŃÖŖCOŗĶH2O£Øg£©µÄ³õŹ¼ÅضČĪŖ0.01mol”¤L-1Ź±£¬H2Ę½ŗāÅضČĪŖ0.005mol”¤L-1”£Čō“ĖŹ±ŌŁ¼ÓČė0.02mol”¤L-1µÄH2O£Øg£©£¬ÖŲŠĀ“ļµ½Ę½ŗāŹ±£¬H2Ę½ŗāÅضČĪŖ | A£®0.0025 mol”¤L-1 | B£®0.0075 mol”¤L-1 | C£®0.010 mol”¤L-1 | D£®0.015 mol”¤L-1 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®ČÜŅŗÖŠc(H+)ŗĶc(OH£)¶¼¼õŠ” | B£®ČÜŅŗÖŠc(H+)Ōö“ó |
| C£®“×ĖįµÄµēĄėĘ½ŗāĻņ×óŅĘ¶Æ | D£®ČÜŅŗÖŠc(OH£)Ōö“ó |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗ¼ĘĖćĢā
 mC(g)+2D(g)£¬¾5min“ļµ½Ę½ŗā£¬“ĖŹ±CĪŖ0.2mol”£ÓÖÖŖŌŚ“Ė·“Ó¦Ź±¼äÄŚDµÄĘ½¾ł·“Ó¦ĖŁĀŹĪŖ0.1mol”¤L-1”¤min-1£¬»Ų“šĻĀĮŠĪŹĢā£ŗ
mC(g)+2D(g)£¬¾5min“ļµ½Ę½ŗā£¬“ĖŹ±CĪŖ0.2mol”£ÓÖÖŖŌŚ“Ė·“Ó¦Ź±¼äÄŚDµÄĘ½¾ł·“Ó¦ĖŁĀŹĪŖ0.1mol”¤L-1”¤min-1£¬»Ų“šĻĀĮŠĪŹĢā£ŗ²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĢīæÕĢā
 2SO3£Øg£© ¦¤H= ”Ŗ196£®6 kJ”¤mol-1
2SO3£Øg£© ¦¤H= ”Ŗ196£®6 kJ”¤mol-1 2NO2£Øg£© ¦¤H= ”Ŗ113£®0 kJ”¤mol-1
2NO2£Øg£© ¦¤H= ”Ŗ113£®0 kJ”¤mol-1 SO3£Øg£©+NO£Øg£©µÄ¦¤H= kJ”¤mol-1
SO3£Øg£©+NO£Øg£©µÄ¦¤H= kJ”¤mol-1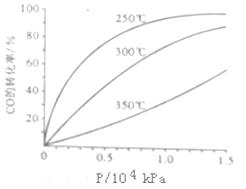
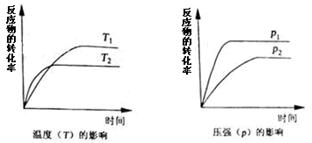
 CH3OH£Øg£©”£COŌŚ²»Ķ¬ĪĀ¶ČĻĀµÄĘ½ŗā×Ŗ»ÆĀŹÓėŃ¹ĒæµÄ¹ŲĻµČēĶ¼ĖłŹ¾”£øĆ·“Ó¦¦¤H 0£ØĢī”°>”±»ņ”° <”±£©”£Źµ¼ŹÉś²śĢõ¼žæŲÖĘŌŚ250”ę”¢1£®3”Į104kPa×óÓŅ£¬Ń”Ōń“ĖŃ¹ĒæµÄĄķÓÉŹĒ ”£
CH3OH£Øg£©”£COŌŚ²»Ķ¬ĪĀ¶ČĻĀµÄĘ½ŗā×Ŗ»ÆĀŹÓėŃ¹ĒæµÄ¹ŲĻµČēĶ¼ĖłŹ¾”£øĆ·“Ó¦¦¤H 0£ØĢī”°>”±»ņ”° <”±£©”£Źµ¼ŹÉś²śĢõ¼žæŲÖĘŌŚ250”ę”¢1£®3”Į104kPa×óÓŅ£¬Ń”Ōń“ĖŃ¹ĒæµÄĄķÓÉŹĒ ”£²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
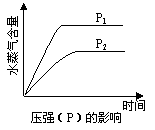
A£®CO2(g) + 2NH3(g) CO(NH2)2(s) + H2O(g)£»”÷H£¼0 CO(NH2)2(s) + H2O(g)£»”÷H£¼0 |
B£®CO2(g) + H2(g) CO(g) + H2O(g)£»”÷H£¾0 CO(g) + H2O(g)£»”÷H£¾0 |
C£®CH3CH2OH (g) CH2£½CH2(g) + H2O(g)£»”÷H£¾0 CH2£½CH2(g) + H2O(g)£»”÷H£¾0 |
D£®2C6H5CH2CH3(g) + O2(g) 2 C6H5CH=CH2(g) + 2H2O(g)£»”÷H£¼0 2 C6H5CH=CH2(g) + 2H2O(g)£»”÷H£¼0 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
 xC(g)“ļµ½Ę½ŗā£¬²āµĆCµÄĪļÖŹµÄĮæ·ÖŹżĪŖc%£»ČōæŖŹ¼³äČėČŻĘ÷ÖŠµÄŹĒ0.6 mol A£¬0.3 mol BŗĶ1.4 mol C£¬“ļĘ½ŗāŹ±CµÄĪļÖŹµÄĮæ·ÖŹżČŌĪŖc%£¬ŌņxµÄÖµæÉÄÜĪŖ
xC(g)“ļµ½Ę½ŗā£¬²āµĆCµÄĪļÖŹµÄĮæ·ÖŹżĪŖc%£»ČōæŖŹ¼³äČėČŻĘ÷ÖŠµÄŹĒ0.6 mol A£¬0.3 mol BŗĶ1.4 mol C£¬“ļĘ½ŗāŹ±CµÄĪļÖŹµÄĮæ·ÖŹżČŌĪŖc%£¬ŌņxµÄÖµæÉÄÜĪŖ| A£®2 | B£®3 | C£®4 | D£®5 |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com