
【题目】钼(Mo)是一种过渡金属元素,它具有强度高、熔点高、耐腐蚀等优点,被广泛应用于钢铁、石油、化工、电气等领域。钼酸钠晶体(Na2MoO4·2H2O)是一种新型水处理剂。某化学兴趣小组利用废钼催化剂(主要成分为MoS2,含少量Cu2S,FeS2)回收Mo并制备钼酸钠晶体,其主要流程图如图所示:
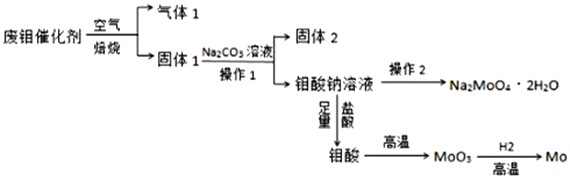
回答下列问题:
(1)可以提高焙烧效率的措施有____________________________________(填一条即可),MoS2中的钼元素在空气中焙烧,很容易被氧化成MoO3,若反应中生成0.1molMoO3,反应中转移电子的数目为____________;
(2)往固体1中加碳酸钠溶液发生反应的化学方程式为______________________________;
(3)操作2为______________________________;
(4)制备钼酸钠晶体还可用通过向精制的MoS2中直接加入次氯酸钠溶液与氢氧化钠溶液进行氧化的方法,若氧化过程中,还有硫酸钠生成,则反应的离子方程式为______________;
(5)已知钼酸钠溶液中c(MoO42-)=0.40molL-1,由钼酸钠溶液制备钼酸钠晶体时,需加入Ba(OH)2固体以除去CO32-,当BaMoO4开始沉淀时,CO32-的浓度为__________________;[已知:Ksp(BaCO3)=2.6×10-9,Ksp(BaMoO4)=4.0×10-8,忽略溶液的体积变化]
(6)锂和二硫化钼形成的二次电池的总反应为:xLi+nMoS2![]() Lix(MoS2)n[Lix(MoS2)n附着在电极上],则电池充电时阳极的电极反应式为__________________________________。
Lix(MoS2)n[Lix(MoS2)n附着在电极上],则电池充电时阳极的电极反应式为__________________________________。
【答案】 将废钼催化剂粉碎或增加空气的进入量 1.4NA MoO3+Na2CO3=Na2MoO4+CO2↑ 蒸发浓缩,冷却结晶 MOS2+9ClO-+6OH-=MoO42-+9Cl-+2SO42-+3H2O 2.6×10-2mol/L Lix(MoS2)n xe = nMoS2 +xLi+
【解析】(1)将废钼催化剂粉碎或增加空气的进入量,都可以提高焙烧效率;根据流程可知,废钼催化剂在空气中焙烧时,MoS2 →MoO3+SO2,钼元素由+4价升高到+6价,硫元素由-2价升高到+4价,因此若反应中生成0.1molMoO3,反应中转移电子的量为0.1×(6-4)+0.1×(4+2)×2=1.4mol,数目为1.4NA ;正确答案:将废钼催化剂粉碎或增加空气的进入量;1.4NA。
(2)根据流程可知,固体1中加碳酸钠溶液生成了钼酸钠和二氧化碳,反应的化学方程式为:MoO3+Na2CO3=Na2MoO4+CO2↑ ;正确答案:MoO3+Na2CO3=Na2MoO4+CO2↑。
(3)从钼酸钠溶液中的得到钼酸钠晶体,可以进行蒸发浓缩,冷却结晶,过滤、洗涤、干燥等操作;正确答案:蒸发浓缩,冷却结晶。
4)次氯酸根离子能够把MOS2直接氧化为MoO42-和SO42-,本身还原为Cl-,反应的离子方程式为MOS2+9ClO-+6OH-=MoO42-+9Cl-+2SO42-+3H2O;正确答案:MoS2+9ClO-+6OH-=MoO42-+9Cl-+2SO42-+3H2O。
(5)根据Ksp(BaMoO4)= c(MoO42-)×c(Ba2+)=0.40×c(Ba2+)=4.0×10-8,c(Ba2+)=1×10-7 molL-1,当BaMoO4开始沉淀时,Ksp(BaCO3)= c(Ba2+)×c(CO32-)=1×10-7×c(CO32-)=2.6×10-9,c(CO32-)= 2.6×10-2mol/L;正确答案:2.6×10-2mol/L。
(6)充电时阳极发生氧化反应,Lix(MoS2)n失电子变为MoS2,电极反应式为Lix(MoS2)n xe = nMoS2 +xLi+;正确答案:Lix(MoS2)n xe = nMoS2 +xLi+。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列有关说法正确的是( )
A. 46g乙醇中含有的共价键总数为7NA
B. FeBr2与等物质的量的Cl2充分反应时转移的电子数为3NA
C. 标准状况下,2.24LCHCl3中含有0.3NA个氯原子
D. 常温常压下,2.0g重水(D2O)中含有NA个中子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是( )
A.氯化钠溶液能导电,所以氯化钠溶液是电解质
B.氯化钠固体不导电,所以氯化钠不是电解质
C.氯化氢溶液能导电,所以氯化氢是电解质
D.氯气溶于水能导电,所以氯气是电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C三种元素,已知A元素原子的K层和M层电子数相同;B元素原子的L层比K层电子数多5个;C元素的+3价阳离子和氖原子具有相同的电子数。
(1)写出A的元素符号___________________;元素C的一种原子(中子数为14)的原子符号_______________;
(2)B的阴离子结构示意图________;A、B组成的化合物的化学式__________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)等质量的氧气和臭氧(O3),它们的物质的量之比为__________,所含分子数之比为__________,所含原子数之比为__________。
(2)中和含0.2molHCl的稀盐酸,需NaOH固体的质量为__________g。
(3)某气态氧化物的化学式为RO2,标准状况下1.28g该氧化物的体积为448mL,则该氧化物的摩尔质量为_____,R的相对原子质量为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是混合物分离的实验,请回答有关问题
实验:通过蒸馏的方法除去自来水中含有的氯离子等杂质制取纯净水,如图所示
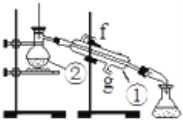
(1)写出下列仪器的名称:①________②________。
(2)若利用以上装置分离酒精和四氯化碳两种溶液的混合物,还缺少的仪器是________,图中装置中进水口是________。(填“f”或“g”)
(3)仪器①中常加入碎瓷片,这样做的目的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】正丁烷与异丁烷互为同分异构体的依据是
A. 具有相同的化学性质 B. 具有相同的物理性质
C. 具有相同的相对分子质量 D. 分子式相同,分子结构不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下反应H2(g)+I2(g)![]() 2HI(g)的平衡常数K=57.0,现向此温度下的真空容器中充入0.2 mol/L H2(g)、0.5 mol/L I2(g)及0.3 mol/L HI(g),则下列说法中正确的是
2HI(g)的平衡常数K=57.0,现向此温度下的真空容器中充入0.2 mol/L H2(g)、0.5 mol/L I2(g)及0.3 mol/L HI(g),则下列说法中正确的是
A. 反应向逆反应方向进行
B. 反应向某方向进行一段时间后c(H2)<0.2 mol/L
C. 若升温后,K减小,说明该反应是吸热反应
D. 反应向某方向进行一段时间后K<57.0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
Ⅰ、稀Na2S溶液有一种臭鸡蛋气味,加入AlCl3溶液后,臭鸡蛋气味加剧,用离子方程式表示气味加剧过程所发生的离子反应方程式_________________________________。
Ⅱ、常温下,向20mL 0.2molL﹣1H2A溶液中滴加0.2molL﹣1NaOH溶液.有关微粒的物质的量变化如下图(Ⅰ代表H2A,Ⅱ代表HA﹣,Ⅲ代表A2﹣)

(1)H2A在水中的电离方程式为_________________________。
(2)当V(NaOH)=20 mL时,写出H2A与NaOH反应的离子方程式_________________。此时溶液中所有离子浓度大小关系:__________________。
(3)向NaHA溶液中加水,HA﹣的电离度_________、溶液的pH________。(填增大、减小、不变、无法确定)。
(4)V(NaOH)=30 mL时,溶液中存在如下关系:2c(H+)﹣2c(OH﹣)________2c(A2﹣)﹣3c(H2A)﹣c(HA﹣)(填“<”“>”或“=”)。
(5)某校研究性学习小组开展了题为“H2A是强酸还是弱酸的实验研究”的探究活动。该校研究性学习小组设计了如下方案:你认为下述方案可行的是_______(填编号);
A.测量浓度为0.05 mol/L H2A溶液的pH,若pH大于1,则可证明H2A为弱电解质
B.可测NaHA溶液的pH。若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸
C.比较中和等体积、等物质的量浓度的硫酸和H2A溶液所需氢氧化钠的量多少,可证明H2A是强酸还是弱酸。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com