
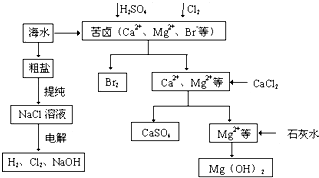
 工业上对海水资源综合开发利用的部分工艺流程如图所示.
工业上对海水资源综合开发利用的部分工艺流程如图所示.

 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:
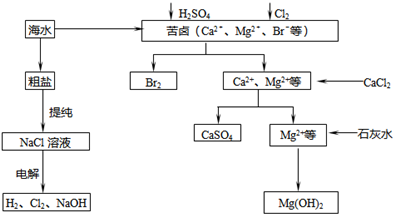 工业上对海水资源综合开发利用的部分工艺流程如图所示.
工业上对海水资源综合开发利用的部分工艺流程如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
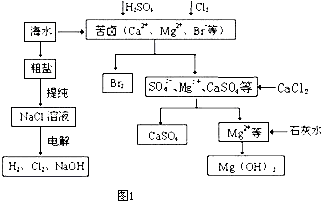
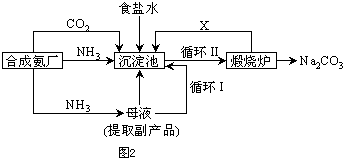
| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
(10分)工业上对海水资源综合开发利用的部分工艺流程如下图所示。
⑴ 粗盐中含有Ca2+、Mg2+、SO42-等杂质,粗制后可得饱和NaCl溶液,精制时通常在溶液中依次中加入过量的BaCl2溶液、过量的NaOH溶液和过量的Na2CO3溶液,过滤后向滤液中加入盐酸至溶液呈中性。请写出加入Na2CO3溶液后相关化学反应的离子方程式:
、 。
⑵ 从海水中提取溴,主要反应为2Br- + Cl2= Br2 + 2Cl-,下列说法错误的是 (填序号)。
A. 溴离子具有氧化性 B. 氯气是还原剂
C. 该反应属于复分解反应 D. Br2是氧化产物
⑶ 本工艺流程中先后制得Br2、CaSO4、Mg(OH)2,能否按Br2、Mg(OH)2、CaSO4的顺序制备?
(填“能”或“否”),原因是 。
查看答案和解析>>
科目:高中化学 来源:2007年普通高等学校招生全国统一考试(山东卷)理综化学部分 题型:填空题
(8分)【化学-化学与技术】
工业上对海水资源综合开发利用的部分工艺流程如下图所示。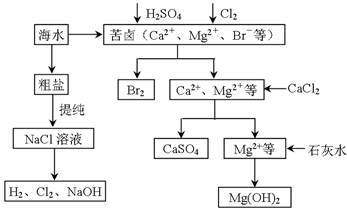
(1)电解饱和食盐水常用离子膜电解槽和隔膜电解槽,离子膜和隔膜均允许通过的分子或离子是 。电解槽中的阳极材料为 。
(2)本工艺流程中先后制得Br2、CaSO4和Mg(OH)2,能否按Br2、Mg(OH)2、CaSO4的顺序制备?原因是 。
(3)膜在四氧化碳中的溶解度比在水中大得多,四氧化碳与水不互溶,故可用于萃取溴,但在上述工艺中却不用四氧化碳,原因是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com