
| A. | 1 mol乙烷在光照条件下最多能与3 mol Cl2发生取代反应 | |
| B. | 石油裂解气能使溴的四氯化碳溶液、酸性KMnO4溶液褪色 | |
| C. | 水煤气可用来合成液态烃、甲醇等有机物 | |
| D. | 苯可通过取代反应制得硝基苯、氯苯 |
分析 A.乙烷分子中含有6个H原子,可完全被取代;
B.石油裂解气含有烯烃;
C.水煤气的主要成分为CO、氢气,可在一定条件下合成烃、甲醇等;
D.苯可在一定条件下发生取代反应.
解答 解:A.乙烷分子中含有6个H原子,可完全被取代,则1 mol乙烷在光照条件下最多能与6 mol Cl2发生取代反应,故A错误;
B.石油裂解气含有烯烃,可与溴发生加成反应,与高锰酸钾发生氧化反应,故B正确;
C.水煤气的主要成分为CO、氢气,可在一定条件下合成烃、甲醇等,故C正确;
D.苯可在一定条件下发生取代反应,可生成硝基苯、氯苯等,故D正确.
故选A.
点评 本题多角度考查有机物的组成、结构和性质,为高考常见题型和高频考点,侧重考查学生的分析能力以及双基的掌握,难度不大,注意把握常见有机物的性质.


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
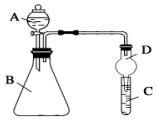 某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
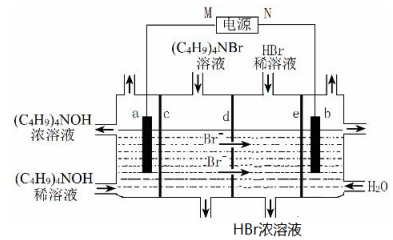
| A. | M为负极 | |
| B. | b极电极反应式:2H2O-4e-=O2↑+4H+ | |
| C. | c、e分别为阳离子交换膜和阴离子交换膜 | |
| D. | 制备 1mol(C4H9)4NOH,理论上 a极产生11.2L气体(标准状况下) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 时间 水样 | 0 | 5 | 10 | 15 | 20 | 25 |
| Ⅰ(pH=2) | 0.4 | 0.28 | 0.19 | 0.13 | 0.10 | 0.09 |
| Ⅱ(pH=4) | 0.4 | 0.31 | 0.24 | 0.20 | 0.18 | 0.16 |
| Ⅲ(pH=4) | 0.20 | 0.15 | 0.12 | 0.09 | 0.07 | 0.05 |
| Ⅳ(pH=4,含Ca2+) | 0.20 | 0.09 | 0.05 | 0.03 | 0.01 | 0 |
| A. | 在0~20 min内,Ⅰ中M的分解速率为0.015 mol•L-1•min-1 | |
| B. | 水样酸性越强,M的分解速率越快 | |
| C. | 在0~20 min内,Ⅲ中M的分解百分率比Ⅱ大 | |
| D. | 由于Ca2+存在,Ⅳ中M的分解速率比Ⅰ快 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
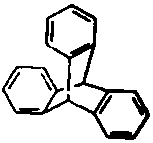
| A. | 三蝶烯是苯的同系物 | |
| B. | 三蝶烯能发生取代反应 | |
| C. | 三蝶烯的一氯代物有6种 | |
| D. | 三蝶烯分子中所有原子可能在同一平面上 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 研究氧化物与悬浮在大气中的海盐粒子的相互作用时,涉及如下反应:
研究氧化物与悬浮在大气中的海盐粒子的相互作用时,涉及如下反应:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c=$\frac{1000ρ×a%}{M}$×2 | B. | a=$\frac{cMV}{1000}$ | C. | c=$\frac{CM}{200ρ}$ | D. | V×ρ×a%=$\frac{cMV}{1000}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com