
实验室制备氨基甲酸铵(NH2COONH4)的反应如下:2NH3(g)+CO2(g)  NH2COONH4(s),该反应在干燥条件下仅生成氨基甲酸铵,若有水存在则生成碳酸铵或碳酸氢铵。
NH2COONH4(s),该反应在干燥条件下仅生成氨基甲酸铵,若有水存在则生成碳酸铵或碳酸氢铵。
(1)该反应在一定条件下能够自发进行,则反应的ΔH 0。(填大于、小于或等于)
(2)写出生成碳酸氢铵的化学方程式 。
(3)按下图装置进行如下实验: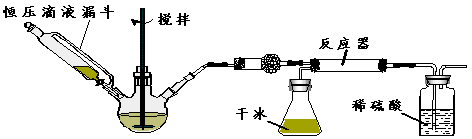
步骤1:检查装置气密性。
步骤2:在相应仪器中装入药品,其中在三颈烧瓶中加入足量的氢氧化钠固体,恒压滴液漏斗中装入浓氨水。
步骤3:滴加浓氨水并搅拌,调节反应速率,在反应器中得到产品
……
①干燥管中盛放的药品是 。
②对比碳酸盐和酸反应制CO2,该实验利用干冰升华产生CO2气体的优点有 。
③以恒压滴液漏斗代替分液漏斗的目的是 。
④反应后期随着CO2气流减慢,导致反应物比例不当,可采取的相应措施是 。
(4)有同学认为该实验装置存在安全问题,请问可能面临的安全问题是 。
(1)小于(2分)
(2)NH3+CO2+H2O=NH4HCO3(2分)
(3)①固体氢氧化钠或碱石灰(2分)
②不需要干燥;提供低温环境,提高转化率(2分 答对任意一点就给分)
③使氨水顺利滴下(2分) ④调节恒压滴液漏斗旋塞,减慢氨水滴加速度(2分)
(4)产品易堵塞导管,稀硫酸会倒吸(2分)
解析试题分析:(1)根据方程式2NH3(g)+CO2(g)  NH2COONH4(s)可知,该反应是熵值减小的可逆反应。如果该反应在一定条件下能够自发进行,则根据△G=△H-T·△S可知,该的焓变ΔH一定小于0。
NH2COONH4(s)可知,该反应是熵值减小的可逆反应。如果该反应在一定条件下能够自发进行,则根据△G=△H-T·△S可知,该的焓变ΔH一定小于0。
(2)有水参加,则生成碳酸氢铵,因此反应的化学方程式为NH3+CO2+H2O=NH4HCO3。
(3)①由于制备氨基甲酸铵的原料氨气必须是干燥的,以防止副反应的发生,因此生成的氨气必须进行干燥。因为氨气是碱性气体,所以干燥氨气应该用固体氢氧化钠或碱石灰。
②碳酸盐和酸反应制CO2,则生成的CO2必须进行净化和干燥处理,而直接利用干冰制备CO2,不需要干燥;又因为该反应是放热反应,提供低温环境,可以提高转化率。
③恒压滴液漏斗代替分液漏斗可以平衡内外压强,使氨水顺利滴下。
④反应后期随着CO2气流减慢,导致反应物比例不当,此时可以通过调节恒压滴液漏斗旋塞,减慢氨水滴加速度加以控制。
(4)由于氨基甲酸铵是固体,所以产品易堵塞导管。又因为氨气极易溶于水,直接插入稀硫酸中吸收氨气,容易使稀硫酸倒吸。
考点:考查物质制备实验方案设计与评价


科目:高中化学 来源: 题型:实验题
硝基苯是重要的精细化工原料,是医药和染料的中间体,还可做有机溶剂。制备硝基苯的过程如下:①配制混酸:组装如下图反应装置。
取100 mL烧杯,用20 mL浓硫酸与浓硝酸18 mL配制混和酸,加入漏斗中。把18 mL苯加入三颈烧瓶中。
②向室温下的苯中逐滴加入混酸,边滴边搅拌,混和均匀。
③在50-60℃下发生反应,直至反应结束。
④除去混和酸后,粗产品依次用蒸馏水和10%Na2CO3溶液洗涤,最后再用蒸馏水洗涤得到粗产品。
已知(1)

(2)可能用到的有关数据列表如下
| 物质 | 熔点/℃ | 沸点/℃ | 密度(20 ℃) / g·cm-3 | 溶解性 |
| 苯 | 5.5 | 80 | 0.88 | 微溶于水 |
| 硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
| 1,3-二硝基苯 | 89 | 301 | 1.57 | 微溶于水 |
| 浓硝酸 |  | 83 | 1.4 | 易溶于水 |
| 浓硫酸 |  | 338 | 1.84 | 易溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
实验室可以用乙醇和浓硫酸在170 ℃制乙烯,化学反应原理:CH3CH2OH CH2=CH2↑+H2O,由于浓硫酸具有强氧化性,其副产物有二氧化硫和二氧化碳等。某同学根据上述信息和实验目标选择下列实验装置设计实验探究(每种装置都有若干个):
CH2=CH2↑+H2O,由于浓硫酸具有强氧化性,其副产物有二氧化硫和二氧化碳等。某同学根据上述信息和实验目标选择下列实验装置设计实验探究(每种装置都有若干个): 
(1)验证乙醇与浓硫酸混合反应副产物有二氧化硫和二氧化碳:
①选择必要装置连接顺序:a→ →f→g→e→d→b(填接口序号);
②确认混合气体中有二氧化碳存在的实验依据是
(2)若制备1,2-二溴乙烷的装置为A→E→C→D,
①D中的反应现象为
②分离1,2-二溴乙烷的操作中使用的玻璃仪器有_____________________________
③有同学建议在A、E之间增加G装置,其作用是
(3)阅读资料知,“酸性高锰酸钾溶液能氧化乙烯生成二氧化碳”。请你设计方案验证资料真实性:
①装置的连接顺序:A→____________________(填装置序号)。
②能证明上述资料符合事实的实验现象是_______________________。
(4)为了探究乙烯与溴水的反应是取代反应还是加成反应,该同学进行如下实验:①测定D瓶中溴水的pH; ②将纯净的乙烯通入D至溶液完全退色;③________。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
实验室用浓硫酸和乙醇制取乙烯时,常会看到烧瓶中液体变黑,并在制得的乙烯中混
有CO2、SO2等杂质。某课外小组设计了如图所示装置,证明乙烯中混有CO2、SO2并验
证乙烯的性质。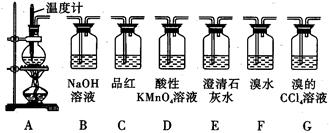
回答下列问题:
(1)烧瓶中素烧瓷片的作用是 。
(2)若要检验A中所得气体含有SO2,可将混合气体直接通入 (填图中代号,下同)装置;若要检验A中所得气体含有CH2=CH2,可将混合气体先通过B装置再通入 装置,也可将混合气体干燥后直接通入 装置。
(3)小明将从A出来的混合气体依次通过B、E、D、E,发现D前面的石灰水中无明显变化、D后面的石灰水变浑浊。请对出现该现象的原因进行合理猜想 。
(4)若要一次性将三种气体全部检验出来:
①检验的顺序是(填气体名称) ;
②上述装置组装的顺序中最简便的是:A→ ,证明C02存在的现象是 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
硫代硫酸钠( Na2S2O3)俗称保险粉,可用于照相业作定影剂,也可用于纸浆漂白作脱氧剂等。实验室可通过如下反应制取:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2。 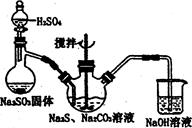
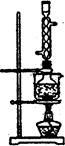
图l 图2
(1)用图l所示装置制取Na2S2O3,其中NaOH溶液的作用是: 。
如将分液漏斗中的H2SO4改成浓盐酸,则三颈烧瓶内除Na2S2O3生成外,还有 (填化学式)杂质生成。
为测定所得保硷粉样品中Na2S2O3·5H2O的质量分数,可用标准碘溶液进行滴定,反应方程式为2 Na2S2O3+I2=2NaI+Na2S4O6。
(2)利用KIO3、KI和HCI可配制标准碘溶液。写出配制时所发生反应的离子方程式: 。
(3)准确称取一定质量的Na2S2O3·5H2O样品于锥形瓶中,加水溶解,并滴加 作指示荆,用所配制的标准碘溶液滴定。滴定时所用的玻璃仪器除锥形瓶外,还有 。
(4)若漓定时振荡不充分,刚看到溶液局部变色就停止漓定,则会使样品中Na2S2O3·5H2O的质量分数的测量结果____(填“偏高”偏低”或“不变”)。
(5)本实验对Na2S的纯度要求较高,利用图2所示的装置可将工业级的Na2S提纯。
已知Na2S常温下微溶于酒精,加热时溶解度迅速增大,杂质不溶于酒精。提纯步骤依次为:
①将已称量好的工业Na2S放入圆底烧瓶中,并加入一定质量的酒精和少量水;
②按图2所示装配所需仪器,向冷凝管中通人冷却水,水浴加热;
③待烧瓶中固体不再减少时,停止加热,将烧瓶取下‘
④ ;
⑤ ;
⑥将所得固体洗涤、干燥,得到Na2S·9H2O晶体。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
工业上常回收冶炼锌废渣中的锌(含有ZnO、FeO、Fe2O3、CuO、Al2O3等杂质),并用来生产Zn(NO3)2·6H2O晶体,其工艺流程为:
有关氢氧化物开始沉淀和沉淀完全的pH如下表:
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 | 5.4 |
| 沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 | 8.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
电镀厂曾采用有氰电镀工艺,由于排放的废水中含有的剧毒CN-离子,而逐渐被无氰电镀工艺替代。处理有氰电镀的废水时,可在催化剂TiO2作用下,先用NaClO将CN-离子氧化成OCN-,再在酸性条件下继续被NaClO氧化成N2和CO2。环保工作人员在密闭系统中用下图装置进行实验,以证明处理方法的有效性,并测定CN-被处理的百分率。将浓缩后含CN-离子的污水与过量NaClO溶液的混合液共200mL(其中CN-的浓度为0.05mol·L-1)倒入甲中,塞上橡皮塞,一段时间后,打开橡皮塞和活塞,使溶液全部放入乙中,关闭活塞。回答下列问题:
(1)乙中反应的离子方程式为 。
(2)乙中生成的气体除N2和CO2外,还有副产物HCl及Cl2等,上述实验是通过测定二氧化碳的量来确定对CN-的处理效果。则丙中加入的除杂试剂是___________(填字母)
| A.饱和食盐水 | B.饱和NaHCO3溶液 | C.浓NaOH溶液 | D.浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
MgSO4?7H2O在医药上常用做泻药,工业上可用氯碱工业中的一次盐泥为原料生产。已知一次盐泥中含有镁、钙、铁、铝、锰的硅酸盐和碳酸盐等成分。其主要工艺如下:
用H2SO4调节溶液PH至1~2,H2SO4作用是 。
(2)加NaClO溶液至PH=5~6并加热煮沸5~10分钟,沉淀2中主要含有MnO2和另外两种难溶物,这两种难溶物的化学式分别为 、 ;其中NaClO溶液将MnSO4转化为MnO2的离子方程式为 。
(3)检验滤液Ⅱ中是否含有Fe3+的实验方法是 。
(4)“操作X”是将溶液 、 、过滤洗涤,即得到MgSO4?7H2O晶体。
(5)准确称量制得的样品5g,用200mL水溶解,加入2 mol?L—1的盐酸5mL,在不断搅拌下滴加足量2 mol?L—1 BaCl2溶液,充分反应后,得沉淀4.46g,则样品纯度为 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
废旧电池进入环境后,对人体带来一系列的致畸、致癌、致变等危害。废电池中主要有铜帽(含Cu、Zn)、锌壳、铁片、石墨、填充物(MnO2、NH4Cl),对废旧电池进行资源化处理的工艺流程如下:
(1)操作A的名称为 ,滤渣的成分为 。
(2)填充物用60℃温水溶解,目的是为了加快溶解速率,但必须控制温度不能太高,其原因是 。
(3)铜帽溶解时加入H2O2的目的是(用化学方程式表示) 。铜帽溶解完全后,需将溶液中过量的H2O2除去,除去H2O2的简便方法是 。
(4)碱性锌锰电池的电解质为KOH,总反应为:Zn+2MnO2+2H2O===2MnOOH+Zn(OH)2,其负极的电极反应式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com