
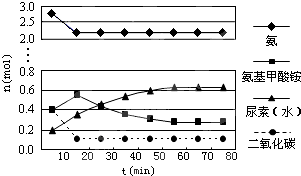
 �����£�Ksp��CaSO4��=9��10-6��������CaSO4��ˮ�еij����ܽ�ƽ��������ͼ������˵
�����£�Ksp��CaSO4��=9��10-6��������CaSO4��ˮ�еij����ܽ�ƽ��������ͼ������˵| A�������£���100mL CaSO4������Һ�У�����400mL 0.01mol/LNa2SO4��Һ����Һ���������� |
| B��b�㽫�г������ɣ�ƽ�����Һ��c��SO42-��һ������3��10-3mol/L |
| C��d����Һͨ���������Ա䵽c�� |
| D��a���Ӧ��Ksp����c���Ӧ��Ksp |
| 0.1L��3.0��10-3mol/L |
| 0.1L+0.4L |
| 0.1L��3.0��10-3mol/L+0.4L��0.01mol/L |
| 0.1L+0.4L |


 ����5��2���ϵ�д�
����5��2���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����ʹpH��ֽ�����ɫ����Һ�У�Fe3+��Cl-��Ba2+��Br-�ܴ������� |
| B������ˮ�м��������Ȼ�������Һ��ʹ��ˮ�����ɫ |
| C����NaClO��Һ��ͨ������������̼�����ӷ���ʽ��2ClO-+CO2+H2O�T2HClO+CO32- |
| D����FeI2��Һ�еμ�������ˮ����Ӧ�����ӷ���ʽΪ��2Fe2++Cl2�T2Fe3++2Cl- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��������������CO��NOX��Ӧ�Ļ�ѧ����ʽΪ��2XCO+2NOX=2XCO2+N2 |
| B��ֲ�����֣������̻����������Ч���Ƴ��п�������Ⱦ |
| C������������Ȼ��������Ϊȼ�ϣ�������ٶԿ�������Ⱦ |
| D������������ȱ���Ǵ������˿�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��Ksp��AgI��С��Ksp��AgCl��g��AgI����ת��ΪAgCl | ||||
| B�������������Ksp���Խ���������Խ����ת��Ϊ�����ܵ������� | ||||
| C��AgI��AgCl��������ˮ������AgCl����ת��ΪAgI | ||||
D�������£�AgCl��Ҫ��NaI��Һ�п�ʼת��ΪAgI����NaI��Ũ�ȱ��벻����
|
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
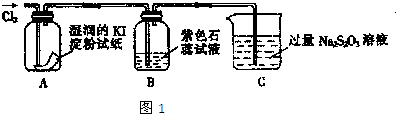
| ||
| ѡ�õ�����������ĸ�� | ������Լ� | ���� |
| ��Ӧ������������壩 | ||
| ����ͭ | ʹ����������ͭ��Ӧ | |
| C |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 [��ѧһѡ��/�л���ѧ����]
[��ѧһѡ��/�л���ѧ����]
�鿴�𰸺ͽ���>>
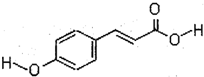
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��Ba2++SO42-�TBaSO4�� |
| B��Fe+2H+�TFe2++H2�� |
| C��Al2O3+6H+�T2Al3++3H2O |
| D��HCO3-+OH-�TCO32-+H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com