
| 温度(℃) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
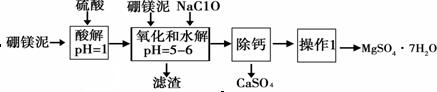
分析 硼镁泥是一种工业废料,主要成份是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,加入硫酸酸解PH=1,得到溶液硫酸镁、硫酸钙、硫酸锰、硫酸铁、硫酸亚铁、硫酸铝,加入次氯酸钠氧化亚铁离子为铁离子,沉淀锰离子,过滤后的滤液中利用溶解度随温度变化,除去硫酸钙,得到硫酸镁溶液,通过蒸发浓缩趁热过滤得到MgSO4•7H2O,
(1)依据配制一定物质的量浓度溶液的一般步骤和实验过程分析选择合适的仪器;
(2)次氯酸根离子具有强的氧化性,能够氧化二价锰离子生成二氧化锰;亚铁离子具有还原性,能够被次氯酸钠氧化;
(4)依据三价铁离子遇到KSCN溶液显血红色设计验证实验过程;
(5)根据表中温度对硫酸镁、硫酸钙的影响完成,温度越高,硫酸钙溶解度越小;
(6)根据硼镁泥中MgO的质量分数(占40%),计算出生成MgSO4•7H2O质量及产率.
解答 解:硼镁泥是一种工业废料,主要成份是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,加入硫酸酸解PH=1,得到溶液硫酸镁、硫酸钙、硫酸锰、硫酸铁、硫酸亚铁、硫酸铝,加入次氯酸钠氧化亚铁离子为铁离子,沉淀锰离子,过滤后的滤液中利用溶解度随温度变化,除去硫酸钙,得到硫酸镁溶液,通过蒸发浓缩趁热过滤得到MgSO4•7H2O,
(1)用98%的浓硫酸来配制1.00mol/L的硫酸80.0mL,应选择100ml容量瓶,一般步骤为:计算、量取、稀释、移液、洗涤、定容、摇匀等,用到的仪器有:量筒、烧杯、玻璃棒、100ml容量瓶,
还需要的玻璃仪器:烧杯、100mL容量瓶、胶头滴管;
故答案为:烧杯、胶头滴管、100mL容量瓶;
(2)NaClO溶液在加热条件下将溶液中的Mn2+氧化成MnO2,反应的离子方程式为Mn2++ClO-+H2O=MnO2↓+2H++Cl-;
故答案为:Mn2++ClO-+H2O═MnO2↓+2H++Cl-;
(3)溶液中含有Fe2+,具有还原性,可与NaClO发生氧化还原反应,反应的离子方程式为:2Fe2++ClO-+2H+=2Fe3++Cl-+H2O;
故答案为:2Fe2++ClO-+2H+═2Fe3++Cl-+H2O;
(4)三价铁离子遇到KSCN溶液显血红色,通常利用KSCN溶液检验三价铁离子的存在,取少量滤液,向其中加入硫氰化钾溶液,如果溶液不变红色,说明滤液中不含Fe3+;如果溶液变红色,说明滤液中含Fe3+;
故选:取少量滤液,向其中加入硫氰化钾溶液,如果溶液不变红色,说明滤液中不含Fe3+;如果溶液变红色,说明滤液中含Fe3+;
(5)有温度对硫酸镁、硫酸钙的溶解度影响,温度越高,硫酸钙溶解度越小,可以采用蒸发浓缩,趁热过滤方法除去硫酸钙;
故答案为:蒸发浓缩,趁热过滤;
(6)100g硼镁泥中氧化镁的物质的量为:$\frac{100g×40%}{40g/mol}$=1mol,根据镁原子守恒,生成MgSO4•7H2O的物质的量为1mol,质量为246g/mol×1mol=246g,MgSO4•7H2O的产率为:$\frac{196.2g}{246g}$×100%=80.0%,
故答案为:80.0%.
点评 本题考查了从硼镁泥中提取MgSO4•7H2O的方法,涉及配制一定物质的量浓度的溶液的仪器选择、铁离子检验方法、物质分离的方法,产率计算等,侧重考查学生分析问题能力,题目难度较大.


科目:高中化学 来源: 题型:选择题
| A. | 2014年11月10日APCE国宴采用的帝王彩瓷餐具和常见的水晶饰品都属于硅酸盐制品 | |
| B. | 20mL0.1mol•L-1NaOH分别与10mL 0.2mol•L-1 CH3COOH、20mL0.1mol•L-1 CH3COOH反应,前者放出的热量比后者少 | |
| C. | Na2SO4•10H2O$?_{冷却}^{受热}$Na2SO4+10H2O利用该反应可以实现太阳能和化学能的相互转换 | |
| D. | 浓硫酸具有不同于稀硫酸的强氧化性、吸水性和脱水性等,主要是由于稀硫酸和浓硫酸中存在的主要微粒不同引起的 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
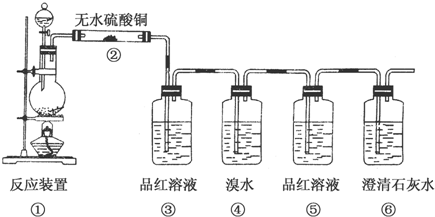
 某化学兴趣小组为探究铜跟浓硫酸的反应,用如图所示装置进行有关实验.请回答:
某化学兴趣小组为探究铜跟浓硫酸的反应,用如图所示装置进行有关实验.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 甲 | 乙 | 丙 |
| ① | CO2 | NH3 | CaCl2 |
| ② | CO2 | SO2 | 石灰水 |
| ③ | NO2 | SO2 | BaCl2 |
| ④ | HCl | CO2 | 石灰水 |
| A. | ②③④ | B. | ①②③ | C. | ①③④ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 臭氧层破坏--氟氯烃 | B. | 光化学烟雾--氮氧化物 | ||
| C. | 水体富营养化--含磷洗衣粉 | D. | 酸雨--二氧化碳 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com