

(1)他能否制得较纯净的Na2CO3?________理由是_________________________________
_____________________________________________________________________________。
按他的设计,第①步实验装置如图所示:
(2)装置A使用的试剂是石灰石和盐酸溶液,可否使用纯碱代替石灰石?________________原因是____________________________________________________________________________________________。
(3)装置B使用的试剂是________________,作用是________________。
(4)有人认为验步骤②③的顺序对调,即先混合,再煮沸,更合理,你认为对吗?为什么?
 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:

| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ | 1.9 | 3.2 |
| Fe2+ | 7.0 | 9.0 |
| Cu2+ | 4.7 | 6.7 |
| 供选择的试剂有:Cl2、H2O2、浓H2SO4、NOH、CuO、Cu | ||
| 11200a |
| V |
| 11200a |
| V |
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知在pH为4~5的溶液中,Cu2+几乎不水解,而Fe3+几乎完全水解.某学生拟用电解CuSO4溶液的方法测定铜的相对原子质量.该同学向pH=3.8酸化的、含有Fe2(SO4)3杂质的CuSO4溶液中加入过量的黑色粉末X,充分搅拌后将滤液用下图所示装置电解,其中某电极增重a g,另一电极上产生标准状况下的气体VmL.下列说法正确的是( )
已知在pH为4~5的溶液中,Cu2+几乎不水解,而Fe3+几乎完全水解.某学生拟用电解CuSO4溶液的方法测定铜的相对原子质量.该同学向pH=3.8酸化的、含有Fe2(SO4)3杂质的CuSO4溶液中加入过量的黑色粉末X,充分搅拌后将滤液用下图所示装置电解,其中某电极增重a g,另一电极上产生标准状况下的气体VmL.下列说法正确的是( )查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
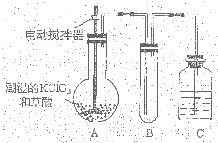 二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水.ClO2可以看做是亚氯酸(HClO2)和氯酸(HClO3)的混合酸酐.工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得.某学生拟用下图所示装置模拟工业制取及收集ClO2.(夹持仪器已省略).回答问题:
二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水.ClO2可以看做是亚氯酸(HClO2)和氯酸(HClO3)的混合酸酐.工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得.某学生拟用下图所示装置模拟工业制取及收集ClO2.(夹持仪器已省略).回答问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com