
【题目】NA为阿伏加德罗常数的值。下列说法正确的是
A.0.1 L 3.0 mol·L-1的NH4NO3溶液中含有的![]() 的数目为0.3NA
的数目为0.3NA
B.1.0 L 0.1 mol·L-1的NaHSO4溶液中,阳离子的数目之和为0.2NA
C.25 ℃时,pH=13的1.0 L Ba(OH)2溶液中含有的OH-数目为0.1NA
D.1 L 0.1 mol·L-1的Na2CO3溶液中所含氧原子数目为0.3NA
【答案】C
【解析】
A.硝酸铵为强酸弱碱盐,![]() 在溶液中水解,则0.1 L 3.0 mol·L-1的NH4NO3溶液中含有的
在溶液中水解,则0.1 L 3.0 mol·L-1的NH4NO3溶液中含有的![]() 的数目小于0.3NA,故A错误;
的数目小于0.3NA,故A错误;
B.H2SO4第一步完全电离,第二步部分电离,NaHSO4在溶液中电离出钠离子和硫酸氢根,硫酸氢根部分电离出氢离子和硫酸根,则1.0 L 0.1 mol·L-1的NaHSO4溶液中,阳离子的数目之和小于0.2NA,故B错误;
C. 25 ℃时,1.0 LpH=13的Ba(OH)2溶液中OH-的物质的量为0.1mol,数目为0.1NA,故C正确;
D.Na2CO3溶液中Na2CO3和水分子中都含有氧原子,则1 L 0.1 mol·L-1的Na2CO3溶液中所含氧原子数目大于0.3NA,故D错误;
故选C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】我国工业废水中几种污染物即其最高允许排放浓度如下表。下列说法不正确的是
污染物 | 汞 | 镉 | 铬 | 铅 | 砷 | 氰化物 |
主要存在形式 |
|
|
|
|
|
|
最高允许排放浓度
|
|
|
|
|
|
|
注:我国规定酸、碱废水pH的最大允许排放标准是大于6、小于![]()
A.![]() 、
、![]() 、
、![]() 是重金属离子
是重金属离子
B.对于![]() 的废水可用中和法处理
的废水可用中和法处理
C.将![]() 转化为
转化为![]() 是用氧化还原的方法
是用氧化还原的方法
D.在含有![]() 的废水中加入
的废水中加入![]() ,可使转变为沉淀而除去
,可使转变为沉淀而除去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置。请回答下列问题:
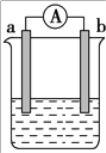
(1)当电极 a 为 Al,电极 b 为 Cu,电解质溶液为浓硝酸时,该电池的 负极为_________(填“Al”或“Cu”),正极的电极反应式为___________。
(2)当电极 a 为 Al,电极 b 为 Mg,电解质溶液为氢氧化钠溶液时,该 电池负极的电极反应式为_____,当反应中收集到标准状况下 224 mL 气体时,消耗的电极质量为_____g。
(3)燃料电池的工作原理是将燃料和氧化剂(如 O2)反应所产生的能量直接转化为电能。现设计一种燃料电池,以对气体吸附能力很强的 Pt 作为两个电极,甲烷为燃料,采用氢氧化钠溶液 为电解质溶液,则通甲烷的电极为_____极(填“正”或“负”),该电池正极的电极反应式 为_____,该电池工作一段时间后,溶液中OH-的浓度将_____(填“增 大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列反应进行判断,下列各微粒氧化能力由强到弱的顺序正确的是( )
①ClO3-+5Cl-+6H+=3Cl2+3H2O ②2FeCl3+2KI=2FeCl2+2KCl+I2 ③2FeCl2+Cl2=2FeCl3
A.ClO3- >Cl2 >I2 >Fe3+B.Cl2> ClO3- >I2 >Fe3+
C.ClO3- >Cl2 >Fe3+ >I2D.ClO3- >Fe3+ >Cl2 >I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表示下列反应的离子反应方程式为
A.NH4HCO3溶于少量的浓KOH溶液中:![]() +
+![]() +2OH-=
+2OH-=![]() + NH3↑+2H2O
+ NH3↑+2H2O
B.向明矾溶液中滴加Ba(OH)2溶液,恰好使![]() 沉淀完全:2Al3++3
沉淀完全:2Al3++3![]() +3Ba2++6OH -=2 Al(OH)3↓+3BaSO4↓
+3Ba2++6OH -=2 Al(OH)3↓+3BaSO4↓
C.向FeBr2溶液中通入足量氯气:2Fe2++4Br-+3Cl2=2 Fe3++2Br2+6 Cl-
D.醋酸除去水垢:2H++CaCO3=Ca2++ CO2↑+ H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用质量分数为98%的浓硫酸(ρ=1.84 g·cm-3)配制240 mL 1.84 mol·L-1稀硫酸,下列操作正确的是
A.将蒸馏水缓慢注入盛有一定量浓硫酸的烧杯中,并不断搅拌至冷却
B.必需的定量仪器有50 mL量筒、250 mL容量瓶和托盘天平
C.量取浓硫酸的体积为25.0 mL
D.先在容量瓶中加入适量水,将量好的浓硫酸注入容量瓶,加水定容
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用碳酸钠晶体(Na2CO3·10H2O,相对分子质量286)来配制0.1mol/L的碳酸钠溶液980mL,假如其他操作均准确无误,下列情况会引起配制溶液的浓度偏高的是
A. 称取碳酸钠晶体28.6g
B. 溶解时进行加热,并将热溶液转移到容量瓶中至刻度线
C. 转移时,对用于溶解碳酸钠晶体的烧杯没有进行洗涤
D. 定容后,将容量瓶振荡摇匀,静置发现液面低于刻度线,又加入少量水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水煤气法制取甲醇(CH3OH)的反应及其反应的焓变、平衡常数如下:
① CH4(g) +1/2O2(g)![]() CO(g) + 2H2(g) △H1 =-35.4kJ·mol-1 平衡常数K1
CO(g) + 2H2(g) △H1 =-35.4kJ·mol-1 平衡常数K1
② CO(g) + 2H2(g) ![]() CH3OH (g) △H2 =-90.1 kJ·mol-1 平衡常数K2
CH3OH (g) △H2 =-90.1 kJ·mol-1 平衡常数K2
③ 2CH4(g) + O2(g) ![]() 2CH3OH(g) △H3 平衡常数K3
2CH3OH(g) △H3 平衡常数K3
(1)在25℃、101kPa下,1g液态甲醇燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为_________________________________。
(2)依据盖斯定律求出反应③ 2CH4(g) + O2(g) ![]() 2CH3OH(g) △H3 =_____kJ·mol-1,相同温度下K3=______(用含K1、K2代数式表示)。
2CH3OH(g) △H3 =_____kJ·mol-1,相同温度下K3=______(用含K1、K2代数式表示)。
(3)下列关于化学反应中的能量及变化理解错误的是(填字母序号)______。
a.反应中活化能的作用是使反应物活化,从而启动反应或改变反应速率
b.化学键的断裂与形成一定伴随着电子的转移和能量变化
c.在一定条件下,某一化学反应是吸热反应还是放热反应,由生成物与反应物的焓值差即焓变(△H)决定
d.氯化钠晶体熔化时,离子键被破坏,吸收能量,发生化学变化
e.200℃、101kPa时,1 mol H2和碘蒸气作用生成HI的反应,热化学方程式表示如下:H2(g)+I2(g) === 2HI(g) △H= -14.9 kJ·mol-1
f.燃烧热定义中“生成稳定的氧化物”,意味着这些氧化物不能再燃烧了
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温、恒容条件下发生下列反应:2X2O5 (g) ![]() 4XO2(g) +O2(g) △H>0,T温度下的部分实验数据为:
4XO2(g) +O2(g) △H>0,T温度下的部分实验数据为:
t/s | 0 | 50 | 100 | 150 |
c(X2O5) mol/L | 4.00 | 2.50 | 2.00 | 2.00 |
下列说法错误的是
A. T温度下的平衡数为K=64 (mol/L)3,100s时转化率为50%
B. 50s 内 X2O5分解速率为 0.03 mol/ (Ls)
C. T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则Kl>K2
D. 若只将恒容改为恒压,其它条件都不变,则平衡时X2O5的转化率和平衡常数都不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com