
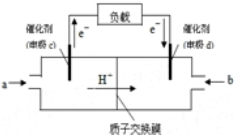
 随着科学技术的进步,人们研制了多种甲醇质子交换膜燃料电池,以满足不同的需求.
随着科学技术的进步,人们研制了多种甲醇质子交换膜燃料电池,以满足不同的需求.分析 (1)原电池放电时,电子从负极沿导线流向正极,根据电子流向知,c是负极、d是正极;根据图知,电解质溶液呈酸性,正极上氧气得电子和氢离子反应生成水;根据氧气和转移电子之间关系式计算氧气体积;
(2)用惰性电极电解硫酸铜溶液时,阳极上氢氧根离子放电生成氧气、阴极上铜离子放电生成Cu;
阴极上析出Cu,所以电解过程中阴极质量增加,体积转移电子相等计算消耗甲醇质量;
根据“析出什么加入什么”原则确定需要加入物质成分.
解答 解:(1)原电池放电时,电子从负极沿导线流向正极,根据电子流向知,c是负极、d是正极;根据图知,电解质溶液呈酸性,正极上氧气得电子和氢离子反应生成水,电极反应式为O2+4H++4e-=2H2O;根据氧气和转移电子之间关系式得氧气体积=$\frac{1mol}{4}×22.4L/mol$=5.6L;
故答案为:正极;O2+4H++4e-=2H2O;5.6L;
(2)用惰性电极电解硫酸铜溶液时,阳极上氢氧根离子放电生成氧气、阴极上铜离子放电生成Cu,所以电池反应式为2CuSO4+2H2O $\frac{\underline{\;通电\;}}{\;}$ 2Cu+O2↑+2H2SO4;
电一段时间后,某电极质量增加1.92g,该电极是阴极,析出的是Cu单质,n(Cu)=$\frac{1.92g}{64g/mol}$=0.03mol,根据转移电子相等计算消耗甲醇质量=$\frac{0.03mol×2}{6}$=0.32g;
要使电解后的溶液恢复原状,采用“析出什么加入什么”原则确定加入物质,电解硫酸铜溶液时,阳极上析出氧气、阴极上析出Cu,所以相当于析出CuO,还可以加入碳酸铜,因为碳酸铜和稀硫酸反应生成硫酸铜和二氧化碳、水,所以还相当于加入CuO,要使溶液恢复原状可以加入CuO或CuCO3,故答案为:2CuSO4+2H2O $\frac{\underline{\;通电\;}}{\;}$ 2Cu+O2↑+2H2SO4;0.32 g;CuO或CuCO3.
点评 本题考查化学电源新型电池电极反应式的书写、化学反应有关计算等知识点,为高频考点,明确各个电极上发生的反应及各个关系式之间关系是解本题关键,注意(2)题加入碳酸铜也能使溶液恢复原状,但加入氢氧化铜不能使溶液恢复原状,为易错点.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 |  |  |  |
| A用海水制蒸馏水 | B将碘水中的碘单质与水直接分离 | C除去Fe(OH)3胶体中的FeCl3 | D稀释浓硫酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3O4与稀硝酸反应:Fe3O4+8 H+═2Fe3+十Fe2++4H2O | |
| B. | 向硫酸铵溶液中加入氢氧化钡溶液:Ba2++So4 2-═BaSO4↓ | |
| C. | 氯化铝溶液中加入过量氨水:Al3++3OH-═Al(OH)3↓ | |
| D. | 含0.4mol FeBr2溶液与0.4mol Cl2恰好反应:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中性重水的pD值为7 | |
| B. | 在1L重水中溶解0.01molDCl,其pD值为4 | |
| C. | 在1L重水中溶解0.01mol NaOD,其pD值为12 | |
| D. | 在100mL 0.25mol/L的DCl重水溶液中加入50mL0.2mol/L的NaOD的重水溶液时,其pD值为1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2为0.4mol/L、O2为0.2mol/L | B. | SO3为0.4mol/L | ||
| C. | SO2、SO3均为0.15mol/L | D. | SO3为0.25mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 合金都一定是两种金属熔合而成 | |
| B. | 涂料属于高分子材料,不属于合成材料 | |
| C. | 水泥与水搅拌静之后会凝固变硬,这是水泥的水硬性 | |
| D. | 我国的陶都和瓷都都是宜兴 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com