
Ŀǰ��ҵ�ϳɰ���ԭ���ǣ�N2(g)+3H2(g) 2NH3(g) ��H=��93.0kJ /mol�����ݱ�����һ�������£�2N2(g)+6H2O(l)
2NH3(g) ��H=��93.0kJ /mol�����ݱ�����һ�������£�2N2(g)+6H2O(l) 4NH3(g)+3O2(g) ��H=" +1530.0kJ" /mol��
4NH3(g)+3O2(g) ��H=" +1530.0kJ" /mol��
��1��������ȼ���ȡ�H=_______________kJ/mol��
��2���ں��º�ѹװ���н��й�ҵ�ϳɰ���Ӧ������˵����ȷ���� ��
| A������������ٱ仯������ƽ�� |
| B�������ܶȲ��ٱ仯����δƽ�� |
| C��ƽ�����װ����ͨ��һ����Ar��ѹǿ���䣬ƽ�ⲻ�ƶ� |
| D��ƽ���ѹ��װ�ã����ɸ���NH3 |
��16�֣�
��1����286.0 ��2�֣���д��������1�֣�
��2��AD ��2�֣�
��3���� C ��2�֣�
�� 0.12 mol / (L��min) ��3�֣�����2�֣���λ1�֣�
�� 0.15 ��2�֣�
��4��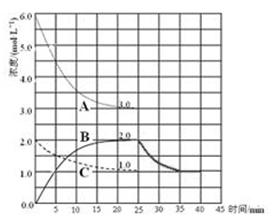 ��3�֣����1�֣��յ�1�֣��ӳ���1�֣�
��3�֣����1�֣��յ�1�֣��ӳ���1�֣�
��5�� 5 ��2�֣�
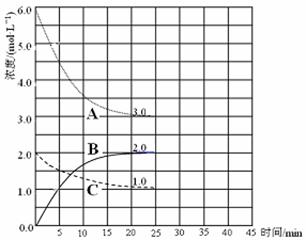
���������������1���Ƚ���֪�����Ȼ�ѧ����ʽ���Ϊ�٢ڣ��ٸ��ݸ�˹���ɣ���(�١�2����)/3�ɵã�2H2(g)+O2(g)= 2H2O(l) ��H=��572.0kJ /mol�����ϵ�����룬���ʱ���֮���룬��H2(g)+O2(g)= 2H2O(l) ��H=��286.0kJ /mol������ȼ���ȸ���ɵã�������ȼ���ȡ�H=��286.0kJ /mol����2�����º�ѹ�£�����Ħ�������ͬ������n=V/Vm��������������ٱ仯��������������ʵ������ٱ仯��˵����Ӧ�Ѵ�ƽ�⣬��A��ȷ�������ܶȵ�����������������������������������غ㶨�ɿ�֪��������ʼ�ղ��䣬�������ܶȲ��ٱ仯ʱ����������������䣬��������ʵ������䣬˵����Ӧ�Ѵ�ƽ�⣬��B����ƽ������������壬ά�ֺ��º�ѹ���������������ݻ�����С�����Ũ�ȣ���ʵ���Ǽ�Сѹǿ��ƽ�����淴Ӧ�������������������ƶ�����C����ƽ���ѹ��װ�ã���С�����ݻ�����ʵ��������ѹǿ��ƽ��������Ӧ��������������С�����ƶ�����D��ȷ����3���ٺϳɰ���ԭ��ΪN2(g)+3H2(g) 2NH3(g)����ͼ��֪��ǰ25min��A��Ũ����6.0mol/L��СΪ3.0mol/L��C��Ũ����2.0mol/L��С��1.0mol/L��B��Ũ����0������2.0mol/L����A��C��B�ı仯Ũ�ȷֱ�Ϊ3.0mol/L��1.0mol/L��2.0mol/L�����A��C��B�ֱ��ʾ�����������Ͱ�����Ũ���淴Ӧʱ��仯�����ߣ�������ǰ25min��������Ũ����6.0mol/L��СΪ3.0mol/L����仯Ũ��Ϊ3.0mol/L����v(H2)=��c(H2)/��t="3.0mol/L��25min" ="0.12" mol / (L��min)���۸����������ݷ��ɵã�
2NH3(g)����ͼ��֪��ǰ25min��A��Ũ����6.0mol/L��СΪ3.0mol/L��C��Ũ����2.0mol/L��С��1.0mol/L��B��Ũ����0������2.0mol/L����A��C��B�ı仯Ũ�ȷֱ�Ϊ3.0mol/L��1.0mol/L��2.0mol/L�����A��C��B�ֱ��ʾ�����������Ͱ�����Ũ���淴Ӧʱ��仯�����ߣ�������ǰ25min��������Ũ����6.0mol/L��СΪ3.0mol/L����仯Ũ��Ϊ3.0mol/L����v(H2)=��c(H2)/��t="3.0mol/L��25min" ="0.12" mol / (L��min)���۸����������ݷ��ɵã�
N2(g)+3H2(g) 2NH3(g)
2NH3(g)
����ֵ���ʼŨ��/ mol��L��1 2.0 6.0 0
����ֵı仯Ũ��/ mol��L��1 1.0 3.0 2.0
����ֵ�ƽ��Ũ��/ mol��L��1 1.0 3.0 2.0
K=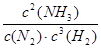 =
=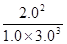 ��0.15��������λ��Ч���֣�
��0.15��������λ��Ч���֣�
��4�����ںϳɰ�������Ӧ�ġ�H=��93.0kJ /mol��������Ӧ�Ƿ��ȷ�Ӧ�������¶ȣ�ƽ�������ȷ�Ӧ�����ƶ�����ƽ�����淴Ӧ�����ƶ�����Ӧ��Ũ��������Ũ�ȼ�С�������������ݷ��ɵã�
N2(g)+3H2(g) 2NH3(g)
2NH3(g)
25minʱ�����Ũ��/ mol��L��1 1.0 3.0 2.0
����ֵı仯Ũ��/ mol��L��1 0.5 1.5 1.0
35minʱ�����Ũ��/ mol��L��1 1.5 4.5 1.0
��ˣ�25min��35min������Ũ����2.0mol/L��СΪ1.0mol/L��35min��40min������Ũ��Ϊ1.0mol/L��ʼ�ձ��ֲ��䣻��5���Ȼ����ǿ�������Σ�����ȫ�������笠����Ӳ���ˮ�⣬����һˮ�ϰ��������ӣ�����ˮ��ƽ�⣬����Һ��������Ũ��Ϊxmol/L�����������ݷ��ɵã�
NH4++H2O NH3?H2O+H+
NH3?H2O+H+
����ֵ���ʼŨ��/ mol��L��1 0.1 0 0
����ֵı仯Ũ��/ mol��L��1 x x x
����ֵ�ƽ��Ũ��/ mol��L��1 0.1��x x x
K= =
=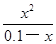 =1.0��10��9
=1.0��10��9
����笠�����ˮ��̶Ⱥ�С����0.1��x��0.1����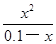 =
=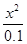 =1.0��10��9����x 2=1.0��10��10��x=1.0��10��5������pH=��lgc(H+)=5��
=1.0��10��9����x 2=1.0��10��10��x=1.0��10��5������pH=��lgc(H+)=5��
���㣺���黯ѧ��Ӧԭ�����漰��˹���ɡ�ȼ���ȡ���ʾȼ���ȵ��Ȼ�ѧ����ʽ����ѧƽ��ı�־�����������ƽ���ƶ���Ӱ�졢��ϵ�����Ũ���뷴Ӧʱ�����ߵ�ʶ��ƽ����Ӧ���ʵļ��㡢��ѧƽ�ⳣ���ļ��㡢���ȷ�Ӧ�����ȷ�Ӧ���¶ȶ�ƽ���ƶ���Ӱ�졢�����¶ȶ�������Ũ���뷴Ӧʱ���ϵ��ͼ������ˮ��ƽ�ⳣ����Ӧ�á�������Һ��pH�ȡ�


 ��Ч���ܿ�ʱ��ҵϵ�д�
��Ч���ܿ�ʱ��ҵϵ�д� �ݾ�ѵ������ϵ�д�
�ݾ�ѵ������ϵ�д� С����ȫ�ܼ��ϵ�д�
С����ȫ�ܼ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
���÷�Ӧԭ���о��������ȡ��⼰�仯����ķ�Ӧ����Ҫ���塣
��1���ڷ�Ӧ��2SO2(g)+O2(g) 2SO3(g)�Ļ����ϵ�У�SO3�İٷֺ������¶ȵĹ�ϵ����ͼ(�������κ�һ�㶼��ʾƽ��״̬����
2SO3(g)�Ļ����ϵ�У�SO3�İٷֺ������¶ȵĹ�ϵ����ͼ(�������κ�һ�㶼��ʾƽ��״̬����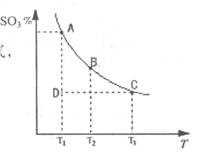
��2SO2(g)+O2(g) 2SO3(g)�ġ�H 0���>����<���������ں��¡���ѹʱ�����ƽ����ϵ��ͨ�뺤��ƽ�⽫ �ƶ�������������ҡ���������
2SO3(g)�ġ�H 0���>����<���������ں��¡���ѹʱ�����ƽ����ϵ��ͨ�뺤��ƽ�⽫ �ƶ�������������ҡ���������
�ڵ��¶�ΪT1����Ӧ���е�״̬Dʱ��V�� V�����>������<����=������
��2������ͼ��һ�������£�N2��H2�������淴Ӧ����1mol NH3�������仯ͼ���÷�Ӧ���Ȼ�ѧ��Ӧ����ʽ ��(��H�ú�Q1��Q2�Ĵ���ʽ��ʾ��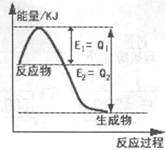
��25��Cʱ����a mol ? L�D1�İ�ˮ��b mol ? L�D1������������ϣ�������Һ��pH=7����c (NH4+) c(Cl�D)��a b���>������<����=������
��3����ˮ�к��д����Ի���̬��ʽ���ڵ��ȡ���Ԫ�ء���֪��250Cʱ��Ksp(AgCl)=1.6��10�D10mol2?L�D2��Ksp(AgI)=1.5��10�D16mol2?L�D2��
�� 250Cʱ���� 10mL0.002mol?L�D1�� NaCl��Һ�е��� 10mL0.002mol?L�D1AgNO3��Һ���а�ɫ�������ɣ���������Һ�м�������0.1mol ?L�D1��NaI��Һ����ɫ������ת��Ϊ��ɫ��������ԭ���� ���÷�Ӧ�����ӷ���ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ʴ���
��14�֣���������Ȼ���еIJ���ѭ����ϵ���¡�
��1��H2S�ڿ����п���ȼ�ա�
��֪�� 2H2S(g) + O2(g)  2S(s) + 2H2O(g) ��H= ��442.38 kJ/mol ��
2S(s) + 2H2O(g) ��H= ��442.38 kJ/mol ��
S(s) + O2(g)  SO2(g) ��H=��297.04 kJ/mol ��
SO2(g) ��H=��297.04 kJ/mol ��
H2S(g)��O2(g)��Ӧ����SO2(g)��H2O(g)���Ȼ�ѧ����ʽ�� ��
��2��SO2�Ǵ�����Ⱦ���ˮ�������õ�����SO2����������������¡�
�� SO2���ں�ˮ����H2SO3��H2SO3���ջ�����SO32��������뷽��ʽ�� ��
�� SO32�����Ա���ˮ�е��ܽ�������ΪSO42������ˮ��pH�� ������ߡ� �������䡱���͡�����
�� Ϊ������ˮ��pH���ɼ������ʵĺ�ˮ��ʹ���е�HCO3�����뷴Ӧ���䷴Ӧ�����ӷ���ʽ�� ��
�� ��������Ӧ��ͬʱ��Ҫ���������������ԭ���� ��
��3����Ȼ��ر���ԭ��ͭ�����ᆳ�������������ú���CuSO4��Һ���������������������ܵ�ZnS������ת��Ϊͭ����CuS�����û�ѧ�����ʾ��ZnSת��ΪCuS�Ĺ��̣� ��
��4��SO2��O2��H2SO4��Һ�п��Թ���ԭ��أ��为����Ӧʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
��1��H2S��ȼ���Ȧ�H�� ��a kJ��mol��1����H2Sȼ�շ�Ӧ���Ȼ�ѧ����ʽΪ ��
��2����֪�������£����ܱ���������H2��ԭWO2�ɵõ������١����¶ȹ���ʱ��WO2(s)��ת��ΪWO2 (g)����������·�Ӧ��
WO2 (s) + 2H2 (g)  W (s) + 2H2O (g)����H�� +66.0 kJ�� mol��1
W (s) + 2H2O (g)����H�� +66.0 kJ�� mol��1
WO2 (g) + 2H2 W (s) + 2H2O (g)����H �� ��137.9 kJ�� mol��1
W (s) + 2H2O (g)����H �� ��137.9 kJ�� mol��1
�����WO2 (s)  WO2 (g) �Ħ�H �� ______________________��
WO2 (g) �Ħ�H �� ______________________��
��3����ҵ�ϳ�������Ȼ��(��Ҫ�ɷ�ΪCH4)��CO2���и��������Ʊ�CO����Ӧ�Ļ�ѧ����ʽΪ��
CH4 + CO2 =" 2CO" + 2H2
��֪CH4��H2��CO��ȼ���ȷֱ�Ϊ890.3 kJ��mol-1��285.8 kJ��mol-1��283.0 kJ�� mol-1��������1 m3(��״��)CO��������Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
�ྦྷ�裨�赥�ʵ�һ�֣�����Ϊ�����Ӵ��õĻ�ʯ�����Ʊ��и�������SiCl4Ϊ������������Ⱦ�ܴ�����ˮǿ��ˮ�⣬�ų��������ȡ��о���Ա����SiCl4ˮ�����ɵ�����ͱ���ۣ���Ҫ�ɷ�ΪBaCO3���Һ�������þ�����ӣ��Ʊ�BaCl2��2H2O�������������£�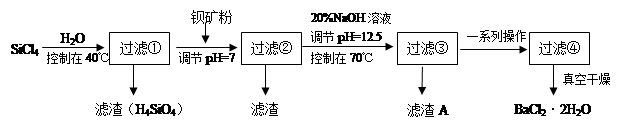
��֪��
�ٳ�����Fe3+��Mg2+��ȫ������pH�ֱ���3.4��12.4
��BaCO3����Է���������197��BaCl2��2H2O����Է���������244
�ش��������⣺
��1��SiCl4����ˮ�ⷴӦ�Ļ�ѧ����ʽΪ_______________________________________
��2����H2��ԭSiCl4��������ȡ���ȺܸߵĹ裬����Ӧ����1mol����ת��ʱ����59KJ��������÷� Ӧ���Ȼ�ѧ����ʽΪ_____________________________________________
��3���ӱ���۲�����pH=7��Ŀ���Ǣ� ����
��4�����ˢں����Һ��Fe3+Ũ��Ϊ ����Һ�¶�25�棬Ksp[Fe(OH)3]=2.2��10-38��
��5����������A�����ӷ���ʽ__________________________________________
��6����ʽ�����10�ֺ�78.8% BaCO3�ı�������������������BaCl2��2H2O������Ϊ���ٶ֣�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
��ҵ�ϳɰ��ķ�ӦΪ��N2(g)+3H2(g)  2NH3(g) ��H<0��ijʵ�齫3.0 mol N2(g)��4. 0 mol H2(g)�����ݻ�Ϊ10L���ܱ������У����¶�T1�·�Ӧ�����H2�����ʵ����淴Ӧʱ��ı仯����ͼ��ʾ��
2NH3(g) ��H<0��ijʵ�齫3.0 mol N2(g)��4. 0 mol H2(g)�����ݻ�Ϊ10L���ܱ������У����¶�T1�·�Ӧ�����H2�����ʵ����淴Ӧʱ��ı仯����ͼ��ʾ��
��1����Ӧ��ʼ3min�ڣ�H2��ƽ����Ӧ����Ϊ ��
��2������������ºϳɰ���Ӧ�Ļ�ѧƽ�ⳣ����д��������̣��������2λ��Ч���֣���
��3�����ı��¶�ΪT2 ( T2С��TI���ٽ���ʵ�飬���ڴ����ͼ�л���H2�����ʵ�����
��Ӧʱ��仯��Ԥ�ڽ��ʾ��ͼ��
��4������úΪ��Ҫԭ�ϵĺϳɰ���ҵ�У�ԭ����������������������ã�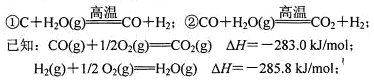
д������CO��H2O(g)��Ӧ���Ȼ�ѧ����ʽ�� ��
��5���ϳɰ���ҵ�У�ԭ����(N2��H2��������CO��NH3���ڽ���ϳ���֮ǰ���ô��������ͭ��I����Һ������CO�䷴ӦΪ��CH3COO[Cu(NH3)2]+CO+NH3 CH3COO[Cu(NH3)3]?CO ��H<0��д�����CO�����ʵ�����һ���ʩ�� ��
CH3COO[Cu(NH3)3]?CO ��H<0��д�����CO�����ʵ�����һ���ʩ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
�Ҵ������DZ��㷺ʹ�õ��������ȼ�ϣ���ҵ�����Ҵ���һ�ַ�Ӧԭ��Ϊ��
2CO(g) + 4H2(g) CH3CH2OH(g) + H2O(g) ��H =" ��256.1" kJ��mol��1
CH3CH2OH(g) + H2O(g) ��H =" ��256.1" kJ��mol��1
��֪��CO(g) + H2O(g) CO2(g)+H2(g) ��H=" ��41.2" kJ��mol��1
CO2(g)+H2(g) ��H=" ��41.2" kJ��mol��1
��1����CO2(g)��H2(g)Ϊԭ��Ҳ�ɺϳ��Ҵ������Ȼ�ѧ����ʽ���£�
2CO2(g) +6H2(g) CH3CH2OH(g) +3H2O(g) ��H = ��
CH3CH2OH(g) +3H2O(g) ��H = ��
��2������ʹ���Ҵ����Ͳ����ܼ���NOx���ŷţ���ʹNOx����Ч������Ϊ�����������Ҫ���⡣
��ij�о�С����ʵ������Ag�C ZSM�C 5Ϊ���������NOת��ΪN2��ת�������¶ȱ仯�������ͼ������ʹ��CO���¶ȳ���800�棬����NO��ת���ʽ��ͣ�����ܵ�ԭ��Ϊ ����n(NO)/n(C O)=1�������£�Ӧ���Ƶ�����¶��� ���ҡ�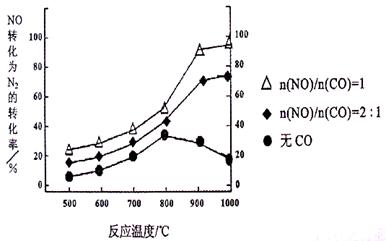
���û���̿��ԭ��������������йط�ӦΪ��C (s) +2NO2(g) N2 (g) + CO2 (g)��ij�о�С����ij�ܱ������м��������Ļ���̿��NO������( T1��)�����·�Ӧ����Ӧ���е���ͬʱ���ø����ʵ�Ũ�����£�
N2 (g) + CO2 (g)��ij�о�С����ij�ܱ������м��������Ļ���̿��NO������( T1��)�����·�Ӧ����Ӧ���е���ͬʱ���ø����ʵ�Ũ�����£�
| �� Ũ��/mol?L��1 ʱ��/min | NO | N2 | CO2 |
| 0 | 1.00 | 0 | 0 |
| 20 | 0.40 | 0.30 | 0.30 |
| 30 | 0.40 | 0.30 | 0.30 |
| 40 | 0.32 | 0.34 | 0.17 |
| 50 | 0.32 | 0.34 | 0.17 |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
50mL0.50mol/L������50mL0.55mol/LNaOH��Һ����ͼ��ʾ��װ���н����кͷ�Ӧ��ͨ���ⶨ��Ӧ���������ų��������ɼ����к��ȡ��ش��������⣺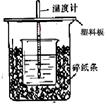
��1����ʵ��װ���Ͽ���ͼ����ȱ�ٵ�һ�ֲ�����Ʒ_____ ___��
��2���ձ���������ֽ����������___________________________��
��3�����ձ����粻��Ӳֽ�壬��õ��к�����ֵ ���ƫ����ƫС�������ޡ�Ӱ�족����
��4��ʵ����60mL0.50mol/L������50mL0.55mol/LNaOH��Һ���з�Ӧ��������ʵ����ȣ����ų������� �����ȡ���������ȡ����������к��� �����ȡ���������ȡ������������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
25��ʱ���ܱ�������X��Y��Z��������ij�ʼŨ�Ⱥ�ƽ��Ũ�����������˵���������
| �� �� | X | Y | Z |
| ��ʼŨ��/mol��L��1 | 0.1 | 0.2 | 0 |
| ƽ��Ũ��/mol��L��1 | 0.05 | 0.05 | 0.1 |
 2Z����ƽ�ⳣ��Ϊ1600
2Z����ƽ�ⳣ��Ϊ1600�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com