

| 编号 | 1 | 2 | 3 | 4 |
| 消耗Na2S2O3标准溶液的体积/mL | 18.02 | 17.98 | 18.00 | 20.03 |
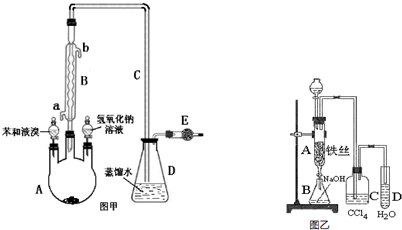
分析 在加热条件下,铜和浓硫酸发生氧化还原反应生成二氧化硫,所以A中发生的反应为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;打开K1,关闭K2,在C中Na2CO3和S、SO2反应生成Na2S2O3,Na2S2O3溶液具有弱碱性和较强的还原性,所以酸性条件下不能存在,二氧化硫不能完全反应且二氧化硫有毒,会污染空气,所以用NaOH吸收未反应的SO2;C中溶液的pH接近7时即停止C中的反应,打开K2,关闭K1,二氧化硫有毒,应该用B中溶液吸收二氧化硫,二氧化硫属于酸性氧化物,且有还原性,所以可以碱性物质或氧化性物质吸收二氧化硫.
(1)①Na2S2O3溶液具有弱碱性和较强的还原性,酸性条件下不能存在;
②从滤液中获取Na2S2O3•5H2O需蒸发浓缩冷却结晶等操作;
③二氧化硫不能完全反应且二氧化硫有毒,会污染空气,应有尾气处理装置;
(2)判断达到滴定终点的现象是滴入最后一滴Na2S2O3时,溶液蓝色消失且半分钟不变色;4号使用的溶液体积与其它几组相比偏差较大,为错误读数,
BaCrO4用盐酸溶解转化为Cr2O2-7,由元素守恒及已知方程式可得关系式:Ba2+~BaCrO4~$\frac{1}{2}$Cr2O72-~$\frac{3}{2}$I2~3S2O32-,结合消耗的Na2S2O3利用关系式计算溶液中n(Ba2+),进而计算c(Ba2+).
解答 解:(1)①生成的SO2和碳酸钠反应生成亚硫酸钠和CO2,由于Na2S2O3在酸性溶液中不能稳定存在,发生硫元素的歧化反应,反应的离子方程式为:S2O32-+2H+═S↓+SO2↑+H2O;
故答案为:S2O32-+2H+═S↓+SO2↑+H2O;
②Na2S2O3•5H2O受热易分解,所需冷却结晶,所以从滤液中获取Na2S2O3•5H2O需蒸发浓缩、冷却结晶等操作,
故答案为:蒸发浓缩,冷却结晶;
③二氧化硫为大气污染物,需要尾气处理,则装置B中盛放的试剂是氢氧化钠溶液,用来吸收SO2,防止污染环境;
故答案为:NaOH溶液;
(2)根据表中数据可知,4号使用的溶液体积与其它几组相比偏差较大,所以舍去,则实际消耗I2标准溶液的体积的平均值是$\frac{18.02+17.98+18.00}{3}$=18.00ml;溶液中发生的反应为:2Ba2++Cr2O72-=2BaCrO4+2H+; Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O;I2+2S2O32-=2I-+S4O62-;根据方程式列出各物质的关系为:
Ba2+~BaCrO4~$\frac{1}{2}$Cr2O72-~$\frac{3}{2}$I2~3S2O32-
1mol 3mol
则n(Ba2+)=$\frac{1}{3}$n(S2O32-)=$\frac{1}{3}$×0.00100mol•L-1×18.00×10-3 L=6×10-6mol,所以c(Ba2+)═$\frac{6×1{0}^{-6}mol}{25×1{0}^{-3}L}$=2.4×10-4mol•L-1,
故答案为:加入最后一滴Na2S2O3标准溶液后,蓝色消失,且半分钟内颜色不改变,2.4×10-4mol•L-1.
点评 本题考查制备实验方案设计,为高频考点,涉及物质制备、物质的量的计算、离子方程式书写、基本操作等知识点,明确实验原理及物质性质是解本题关键,注意(2)题计算时4号要舍去,为易错点,题目难度中等.


 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8种 | B. | 9种 | C. | 10种 | D. | 11种 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、纺织等工业.乙酸乙酯的实验室和工业制法如下:
酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、纺织等工业.乙酸乙酯的实验室和工业制法如下:| 同一反应时间 | 同一反应温度 | ||||
| 反应温度 | 转化率(%) | 选择性(%) | 反应时间 | 转化率(%) | 选择性(%) |
| 40℃ | 77.8 | 100 | 2h | 80.2 | 100 |
| 60℃ | 92.3 | 100 | 3h | 87.8 | 100 |
| 80℃ | 92.6 | 100 | 4h | 92.3 | 100 |
| 120℃ | 94.5 | 98.7 | 6h | 93 | 100 |
| 注:选择性100%表示反应生成的产物是乙酸乙酯和水 | |||||
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 三氯化磷(PCl3)是合成药物的重要化工原料,可通过白磷和氯气化合得到.
三氯化磷(PCl3)是合成药物的重要化工原料,可通过白磷和氯气化合得到.| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 |
| 白磷 | 44.1 | 280.5 | 1.82 |
| PCl3 | -112 | 75.5 | 1.574 |
| POCl3 | 2 | 105.3 | 1.675 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 水合肼 (N2H4•H2O) 常用作还原剂和抗氧剂,其熔点为-40℃,沸点 118.5℃,极毒.实验室用如下装置制取水合肼(N2H4•H2O)涉及下列反应:
水合肼 (N2H4•H2O) 常用作还原剂和抗氧剂,其熔点为-40℃,沸点 118.5℃,极毒.实验室用如下装置制取水合肼(N2H4•H2O)涉及下列反应:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 最近意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子.N4分子结构如图所示,已知断裂1mol N-N吸收167kJ热量,生成1mol N≡N放出942kJ.根据以上信息和数据,下列说法正确的是( )
最近意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子.N4分子结构如图所示,已知断裂1mol N-N吸收167kJ热量,生成1mol N≡N放出942kJ.根据以上信息和数据,下列说法正确的是( )| A. | N4与N2互为同分异构体 | |
| B. | 1mo1N4气体转变为N2将吸收882kJ热量 | |
| C. | N4(g)=2N2(g)△H=-882KJ | |
| D. | P4(白磷)的分子结构与N4相似,1mol N4和1mol P4均含有6mol非极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硝酸钾、氢氧化钠 | B. | 氧化铜、二氧化锰 | C. | 氯化钾、二氧化锰 | D. | 硫酸铜、氢氧化钡 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com