
����Ŀ��[��ѧ����ѡ��3�����ʽṹ������]̼�ǵ���������������������Ԫ��֮һ������Ҫ��ش��������⣺
(1)̼ԭ�ӵļ۵����Ų�ʽ______________��������_________�ֲ�ͬ�˶�״̬�ĵ��ӡ�
(2)̼�����γɶ����л��������ͼ��ʾ��һ�����ʺ�һ����वĽṹ�����ַ���������ԭ�Ӷ���һ��ƽ���ϡ�
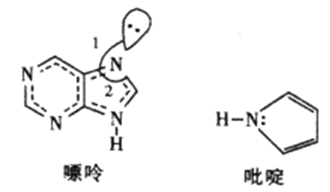
������������Ԫ�صĵ縺���ɴ�С��˳��__________________��
�������й��֮��ļнǡ�1�ȡ�2����ԭ��__________________��
����ऽṹ��Nԭ�ӵ��ӻ���ʽ__________________��
�ܷ����еĴ�м����÷��Ŧ�![]() ��ʾ��m�����γɴ�м���ԭ������n���������γɴ�м��ĵ�����������ऽṹ�еĴ�м���ʾΪ__________��
��ʾ��m�����γɴ�м���ԭ������n���������γɴ�м��ĵ�����������ऽṹ�еĴ�м���ʾΪ__________��
(3)̼Ԫ�����γ�CO��CO2��H2CO3�ȶ����������
�ٶ�����̼�ľ�������ɱ���ÿ��������̼������Χͨ����__________�����ڵķ��ӡ�
����COת����CO2�ķ�Ӧ�����У�����˵����ȷ����__________��
A.�����йµ��Ӷ������� B.���ӵļ��Է����仯
C.ԭ�Ӽ�ɼ���ʽ�����ı� D.���Ӿ�����۷е�����
��H2CO3��H3PO4����1�����ǻ�����H3PO4Ϊ��ǿ�ᣬH2CO3Ϊ�����ԭ��_________��
(4)2017�꣬�����ѧ���Ŷӹ�ͬ�ϳ���̼��һ������ͬ�������壺T-̼��T-̼�Ľṹ�ǽ��������ʯ�е�ÿ��̼ԭ����һ����4��̼ԭ����ɵ���������ṹ��Ԫȡ���γ�̼��һ��������ά��������ṹ������ͼ����֪T̼��������Ϊa pm������٤������ΪNA����T̼���ܶȵı���ʽΪ__________g/cm3��(д������ʽ����)

���𰸡� 2S22P2 6 N<C>H(��NCH) �µ��Ӷ�����ϵ��Ӷ�֮��ij������ڼ��ϵ��Ӷ�֮��ij�����������Ǵ� sp2 ![]() 12 BCD ����Һ��ˮ������̼����ֻ��Լ���ٷ�֮һ��ˮ��ϳ�̼���밴������̼ȫ��ת��Ϊ̼��������������ǿ�������Ȼ��С�˽��ٱ���
12 BCD ����Һ��ˮ������̼����ֻ��Լ���ٷ�֮һ��ˮ��ϳ�̼���밴������̼ȫ��ת��Ϊ̼��������������ǿ�������Ȼ��С�˽��ٱ��� ![]()
��������(1)̼Ϊ6��Ԫ�أ�ԭ�ӵļ۵����Ų�ʽΪ2S22P2��������6�ֲ�ͬ�˶�״̬�ĵ��ӣ�(2) ��Ԫ�طǽ�����Խǿ�縺��Խǿ��������������Ԫ�صĵ縺���ɴ�С��˳��ΪN<C>H���ڹµ��Ӷ�����ϵ��Ӷ�֮��ij������ڼ��ϵ��Ӷ�֮��ij�����������Ǵ������й��֮��ļнǡ�1�ȡ�2�����N������̼�ɼ�����һ��δ�ɶԵ��Ӻ��������̼ԭ���γɴ�м�![]() ����˷��������Ե�Sp2�ӻ����ܷ����еĴ�м����÷���
����˷��������Ե�Sp2�ӻ����ܷ����еĴ�м����÷���![]() ��ʾ��m�����γɴ�м���ԭ������n���������γɴ�м��ĵ�����������ऽṹ�еĴ�м���ʾΪ
��ʾ��m�����γɴ�м���ԭ������n���������γɴ�м��ĵ�����������ऽṹ�еĴ�м���ʾΪ![]() ��(3)�ٸɱ��Ƿ��Ӿ��壬CO2����λ��������Ķ���������ϣ��Զ����ϵ�CO2����Ϊ�����������������CO2���ӷֲ�����ö���������12����������ϣ�����COת����CO2�ķ�Ӧ�����У� A.�����йµ��Ӷ�����2�Ա�Ϊ4�ԣ������仯��ѡ��A���� B.���ӵļ��Է����仯���ɼ��Է��ӱ�Ϊ�Ǽ��Է��ӣ�ѡ��B��ȷ��C.ԭ�Ӽ�ɼ���ʽ�����ı䣬��Ϊ̼��˫����ѡ��C��ȷ��D.���Ӿ�����۷е����ߣ�ѡ��D��ȷ����ѡBCD����H2CO3��H3PO4����1�����ǻ�����H3PO4Ϊ��ǿ�ᣬH2CO3Ϊ�����ԭ��Ϊ����Һ��ˮ������̼����ֻ��Լ���ٷ�֮һ��ˮ��ϳ�̼���밴������̼ȫ��ת��Ϊ̼��������������ǿ�������Ȼ��С�˽��ٱ��ˣ�(4) ����ԭ�Ӿ�̯���ɼ���T̼�����к���̼ԭ�Ӹ���Ϊ
��(3)�ٸɱ��Ƿ��Ӿ��壬CO2����λ��������Ķ���������ϣ��Զ����ϵ�CO2����Ϊ�����������������CO2���ӷֲ�����ö���������12����������ϣ�����COת����CO2�ķ�Ӧ�����У� A.�����йµ��Ӷ�����2�Ա�Ϊ4�ԣ������仯��ѡ��A���� B.���ӵļ��Է����仯���ɼ��Է��ӱ�Ϊ�Ǽ��Է��ӣ�ѡ��B��ȷ��C.ԭ�Ӽ�ɼ���ʽ�����ı䣬��Ϊ̼��˫����ѡ��C��ȷ��D.���Ӿ�����۷е����ߣ�ѡ��D��ȷ����ѡBCD����H2CO3��H3PO4����1�����ǻ�����H3PO4Ϊ��ǿ�ᣬH2CO3Ϊ�����ԭ��Ϊ����Һ��ˮ������̼����ֻ��Լ���ٷ�֮һ��ˮ��ϳ�̼���밴������̼ȫ��ת��Ϊ̼��������������ǿ�������Ȼ��С�˽��ٱ��ˣ�(4) ����ԭ�Ӿ�̯���ɼ���T̼�����к���̼ԭ�Ӹ���Ϊ![]() ��
�� 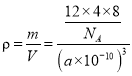 ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йػ�ѧ��Ӧ���ʺ��ȵ�˵���У�����ȷ����(����)
A. ʵ�����ù�������ֽ�������������������̣���Ӧ�������Լӿ�
B. �ڽ�����������ˮ��Ӧ�У�����ˮ�����ܼӿ췴Ӧ����
C. 2SO2��O2![]() 2SO3��Ӧ�У����Ӷ�����������ɼӿ췴Ӧ����
2SO3��Ӧ�У����Ӷ�����������ɼӿ췴Ӧ����
D. ʵ������̼��ƺ����ᷴӦ��ȡ������̼����̼��Ʒ�ĩ�ȿ�״��ӦҪ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Լ�����һ�̴ֹ������ʣ�����������ͨ��ϸ��Ĥ��ɢ��ϸ���ڲ�������Ҫ��ϸ��������ṹ�����й�
A. Ĥ������ǵ��� B. Ĥ�ں�����Ӧ�������
C. Ĥ��ѡ������ D. Ĥ�Ļ����Ǽ�Ϊ֬˫��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʽΪC3H6Cl2����״�л�����(�����������칹)��������
A. 5�� B. 4�� C. 3�� D. 2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��H++OH���TH2O����ʾ�Ļ�ѧ��Ӧ�ǣ�������
A.4HNO3 ![]() 2H2O+4H2O��+O2��
2H2O+4H2O��+O2��
B.NaOH+HCl�TNaCl+H2O
C.CaCO3+2HCl�TCaCl2+CO2��+H2
D.2H2+O2 ![]() 2H2O
2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������̫���ܵ����Ҫ�ߴ��ȵĹ裬��ҵ���Ƹߴ��賣�����·�Ӧʵ��:
��Si(s) +3HCl(g)![]() SiHCl3(g) + H2(g) ��H= -381kJ/mol
SiHCl3(g) + H2(g) ��H= -381kJ/mol
��SiHCl3(g)+H2(g)![]() S(s) + 3HCl(g)
S(s) + 3HCl(g)
������������Ӧ������������������ȷ����
A. ������Ӧ�����û���Ӧ B. ��Ӧ�������ȷ�Ӧ
C. ������Ӧ��Ϊ���淴Ӧ D. ������Ӧ����������ԭ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ϩ�����SM����ʯ����ҵ����Ҫ����ԭ�ϣ���Ҫ������������ϩϵ����֬������������ϩ�ܷ�������һϵ�б仯������˵������ȷ����
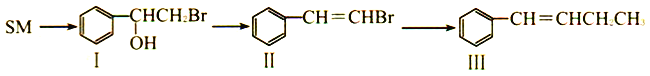
A. �л���SM��ʹ������Ȼ�̼��Һ��ɫ
B. �л���I��������Ʒ�Ӧ�ų�H2
C. �л���I��II���ܷ���������Ӧ�ͼӳɷ�Ӧ
D. �л���I��ͬ���칹���У�������ֻ��һ�������Һ���̼̼˫���Ľṹ��4��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��H2��CO��CH4��CH3OH�ȶ�����Ҫ����Դ��Ҳ����ҪΪ����ԭ�ϡ�
��1����֪25�棬1.01��105Paʱ��,8.0DgCH4��ȫȼ�����ɶ�����̼�����Һ̬ˮ�ų�444.8kJ������дɽ�÷�Ӧ���Ȼ�ѧ��Ӧ����ʽ��____________________��
��2��Ϊ���������ܼ�����������̼�����������ʹ�����CO2�ĺ�������Ч�ؿ�������CO2����ҵ�Ͽ�����CO2������ȼ�ϼ״���
�����Ϊ2L���ܱ������У�����lmolCO2��3molH2��һ�������·�����Ӧ��CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)�������CO2��CH3OH(g)�����ʵ�����ʱ��仯��ͼ��ʾ��
CH3OH(g)+H2O(g)�������CO2��CH3OH(g)�����ʵ�����ʱ��仯��ͼ��ʾ��
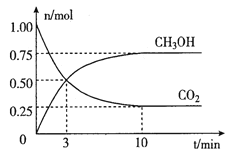
�ٴӷ���ʼ��ƽ����CO2��ƽ����Ӧ����v(CO2)=____��
�ڴﵽƽ��ʱ��H2��ת����Ϊ__________��
�����д�ʩ������߷�Ӧ���ʵ���__________��
A.�����¶� B.������� C.����ѹǿ D.��ʱ�����CH3OH
��3����ҵ��Ҳ��CO��H2Ϊԭ���Ʊ�CH3OH����Ӧ����ʽΪ��CO(g)+2H2(g)![]() CH3OH(g)����һ����̶����ܱ�������Ͷ��һ������CO��H2�������������Ӧ��������������˵��������Ӧ�ﵽƽ��״̬����______��
CH3OH(g)����һ����̶����ܱ�������Ͷ��һ������CO��H2�������������Ӧ��������������˵��������Ӧ�ﵽƽ��״̬����______��
A.��Ӧ��CO��CH3OH�����ʵ���֮��Ϊ1:1
B.��������ѹǿ����ʱ��ı仯���仯
C.��λʱ����ÿ����1molCO��ͬʱ����1mclCH3OH
D.CH3OH�����������ڻ�������б��ֲ���
E.���������ܶȱ��ֲ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͪ�����һ�����õĿ�����ʹҩ������ͨ�����·����ϳ�:

(1)������D�����������ŵ�����Ϊ__________________��_____________________��
(2)������E�Ľṹ��ʽΪ__________________����B��C�ķ�Ӧ������____________��
(3)д��C��D�ķ�Ӧ����ʽ____________________________________��
(4)B��ͬ���칹���ж��֣�����ͬʱ����������������_____�֡�
I.���ڷ����廯����
II.�ܷ���������Ӧ
III.��˴Ź���������5�鲨�壬�������Ϊ1:1:1:1:3
(5)��д���Լױ�Ϊԭ���Ʊ�������![]() �ĺϳ�·������ͼ____(���Լ�����ѡ)���ϳ�·������ͼʾ����ͼ:
�ĺϳ�·������ͼ____(���Լ�����ѡ)���ϳ�·������ͼʾ����ͼ:![]() ��
��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com