
| 物质 | α-Al2O3 | γ-Al2O3 |
| 性质 | 不溶于水和酸 | 不溶于水,溶于强酸或强碱,加热至1200℃可转化为α-Al2O3 |
| 温度/℃ 溶解度/g |
0 | 20 | 40 | 60 | 80 | 100 |
| Al2(SO4)3 | 31.2 | 36.4 | 46.1 | 59.2 | 73.0 | 89.0 |
| 明矾 | 3.0 | 5.9 | 11.7 | 25 | 71 | 154 |
| 333(C1V1-4C2V2) |
| 103m |
| 333(C1V1-4C2V2) |
| 103m |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2013届江苏省苏南四校高三12月月考试化学试卷(带解析) 题型:填空题
(14分)以明矾石[主要成分为K2SO4·Al2(SO4)3·2A12O3·6H2O]为原料生产硫酸铝晶体[Al2(SO4)3·18H2O]和明矾[KAl(SO4)2·12H2O]的实验流程如下: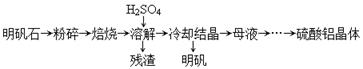
两种不同形态的氧化铝的部分性质如下表:
| 物质 | α-Al2O3 | γ-A12O3 |
| 性质 | 不溶于水和酸 | 不溶于水,溶于强酸或强碱,加热至1200℃可转化为α- Al2O3 |
| 温度/℃ 溶解度/g | 0 | 20 | 40 | 60 | 80 | 100 |
| Al2(SO4)3 | 31.2 | 36.4 | 46.1 | 59.2 | 73.0 | 89.0 |
| 明矾 | 3.0 | 5.9 | 11.7 | 25 | 71 | 154 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江苏省苏南四校高三12月月考试化学试卷(解析版) 题型:填空题
(14分)以明矾石[主要成分为K2SO4·Al2(SO4)3·2A12O3·6H2O]为原料生产硫酸铝晶体[Al2(SO4)3·18H2O]和明矾[KAl(SO4)2·12H2O]的实验流程如下:
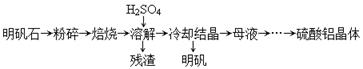
两种不同形态的氧化铝的部分性质如下表:
|
物质 |
α-Al2O3 |
γ-A12O3 |
|
性质 |
不溶于水和酸 |
不溶于水,溶于强酸或强碱,加热至1200℃可转化为α- Al2O3 |
Al2(SO4)3、明矾在不同温度下的溶解度如下表:
|
温度/℃ 溶解度/g |
0 |
20 |
40 |
60 |
80 |
100 |
|
Al2(SO4)3 |
31.2 |
36.4 |
46.1 |
59.2 |
73.0 |
89.0 |
|
明矾 |
3.0 |
5.9 |
11.7 |
25 |
71 |
154 |
(1) “焙烧’’温度过高,会导致硫酸铝晶体产量降低,其原因是 。
(2)从“母液”制备硫酸铝晶体的实验步骤为:① ;② ;③过滤、洗涤、干燥。
(3)测定硫酸铝晶体样品中Al2(SO4)3·18H2O质量分数的实验步骤为(EDTA分别能与Al3+或Pb2+以物质的量之比1:1进行反应):
步骤1:准确称取硫酸铝晶体样品mg,溶于25 mL水中。
步骤2:加入c1 mo1·L-1EDTA溶液V1mL(过量),煮沸、冷却,稀释至100 mL。
步骤3:取25. 00mL上述稀释液,滴加指示剂,用c2 mol·L-1Pb(NO3)2标准溶液滴定过量的EDTA溶液,达到终点时消耗v2mL Pb(NO3)2标准溶液。
①步骤2中“稀释至100 mL”时,需要用到的玻璃仪器有烧杯、玻璃棒、量筒、 。
②根据上述数据计算,该样品中Al2(SO4)3·18H2O的质量分数为 。(用含字母的代数式表示)。
(4)铝的阳极氧化法是把铝作为阳极,置于硫酸等电解液中,施加阳极电压进行电解,在铝的表面形成一层致密的氧化膜。
①电解过程中阳极的电极反应为 。
②取少量废电解液,加入NaHCO,溶液后产生气泡和白色沉淀,产生沉淀的原因是 。(用离子方程式表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com