
现有含Fe(NO3)3、Cu(NO3)2、HNO3的某稀溶液,若向其中逐步加入铁粉,溶液中Fe2+浓度与加入铁粉的物质的量之间的关系如图所示,则该溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为
| A.1∶1∶3 | B.1∶2∶4 | C.1∶1∶4 | D.1∶3∶1 |
C
解析试题分析:由图可知,加入铁粉后反应先后顺序是:Fe+4HNO3=Fe(NO3)3+NO↑+2H2O、Fe+2Fe(NO3)3=3Fe(NO3)2、Fe+Cu(NO3)2=Fe(NO3)2+Cu;设HNO3、Fe(NO3)3、Cu(NO3)2分别为xmol、ymol、zmol,由于先加入1molFe时没有生成Fe2+,只生成1mol Fe(NO3)3,由系数之比等于物质的量之比可得:n(HNO3)=4n(Fe),则x=4;再加入1molFe时生成3molFe2+,说明参加反应的Fe(NO3)3为2mol,则y=1;最后加入1molFe时生成1mol Fe2+,说明z=1;因此,该溶液中Fe(NO3)3、Cu(NO3)2、HNO3分别为1mol、1mol、4mol,三者的浓度之比为1∶1∶4,故C正确。
考点:本题以铁及其化合物的重要性质为线索,以图像为载体,主要考查氧化还原反应的先后顺序、物质的量在化学方程式计算中的应用、物质的量浓度的计算等基础知识和基本技能。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:单选题
下列反应中氯元素被氧化的是( )
A.MnO2+4HCl MnCl2+2H2O+Cl2↑ MnCl2+2H2O+Cl2↑ |
| B.2HCl+Ca(OH)2=CaCl2+2H2O |
| C.5Cl2+I2+6H2O=10HCl+2HIO3 |
D.2KClO3 2KCl+3O2↑ 2KCl+3O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
铋(Bi)位于元素周期表中VA族,其价态为+3时较稳定,铋酸钠(NaBiO3)可氧化硫酸锰(MnSO4),反应的离子方程式为5NaBiO3+2Mn2++14H+=2MnO- 4+5Bi3++Na++7H2O,下列说法错误的是
| A.若有0.1mol氧化产物生成,则转移0.5mol电子 |
| B.铋酸钠难溶于水 |
| C.该反应可以用于鉴定Mn2+离子 |
| D.该反应可以用浓盐酸酸化 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在熔融KOH中大气中的氧可将铬铁矿FeCr2O4中Fe和Cr的化合价都转化为+6价,氧化 1 mol FeCr2O4在理论上需要多少摩尔氧气
| A.2mol | B.2.5mol | C.3mol | D.4mol |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知5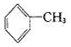 +6KMnO4+9H2SO4=3K2SO4+6MnSO4+14H2O+_______。
+6KMnO4+9H2SO4=3K2SO4+6MnSO4+14H2O+_______。
下列说法不正确的是
A.氧化产物为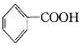 | B. 作氧化剂 作氧化剂 |
| C.每1mol KMnO4转移5mol e- | D.H2SO4起酸的作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
将1.95g锌粉加入到200mL的0.100 mol·L-1MO2+溶液中,恰好完全反应,则还原产物可能是( )
| A.M | B.M2+ | C.M3+ | D.MO2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知Br2+ 2Fe2+ = 2Fe3++ 2 Br-,当向含1 molFeBr2溶液中逐渐通入Cl2,溶液中有一半的Br-氧化时,下列判断不正确的是
| A.反应前后溶液的颜色发生了改变 |
| B.反应后溶液中c(Cl-)= C(Br-) |
| C.参加反应的Cl2为1 mol |
| D.反应的离子方程式为:2Fe2++ 2Br- + 2Cl2= 2Fe3++ Br2 + 4Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
次磷酸钠(NaH2PO2)可用于化学镀镍。
(1)化学镀镍的溶液中含有Ni2+和H2PO2-,在酸性条件下发生以下镀镍反应:
① Ni2+ + H2PO2-+ → Ni + H2PO3-+
② 6H2PO2- +2H+ →2P+4H2PO3-+3H2↑
请配平反应式①。
(2)反应式①中还原剂是 ,被还原元素是 。
(3)反应②中,若生成1 mol H2PO3-,反应中转移电子的物质的量为 mol。
(4)从二个反应分析,若生成1mol Ni和1mol P,同时有 mol H2PO3-生成。
(5)完成下列各小题中的化学反应方程式:
碱金属与O2反应生成氧化物较复杂,有普通氧化物(如K2O)过氧化物(如K2O2)还有超氧化物和臭氧化物等。要制备碱金属的普通氧化物一般是用碱金属还原对应的过氧化物、硝酸盐或亚硝酸盐。写出下列化学反应式:
①钠与过氧化钠反应
②钾还原硝酸钾,同时还产生了一种单质气体
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
高温条件下,辉铜矿(主要成分为Cu2S)通适量的空气可冶炼金属铜,经过一系列反应可得到B和D、E。G为砖红色沉淀。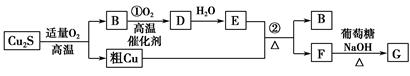
请回答下列问题:
(1)辉铜矿(Cu2S)通适量的空气冶炼金属铜的化学方程式为 ,其中氧化剂为 。
(2)E的浓溶液与Cu发生反应②的化学方程式是 。
(3)利用电解可提纯铜,在该电解反应中阳极物质是 ,电解质溶液是 。
(4)自然界中当胆矾矿与黄铁矿(主要成分为FeS2)相遇时会缓慢发生下列反应产生辉铜矿。对反应:14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4,被氧化的硫和被还原的硫的质量比为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com