
分析 D、E、X、Y、Z是短周期元素,且原子序数逐渐增大,它们的最简单氢化物分子的空间结构依次是正四面体、三角锥形、正四面体、角形(V形)、直线型,形成正四面体结构的氢化物是甲烷或硅烷,形成三角锥型的氢化物是氨气,形成V型的氢化物是水或硫化氢,形成直线型结构的氢化物是乙炔、氟化氢或氯化氢,这几种元素的原子序数逐渐增大,所以D的氢化物是甲烷,E的氢化物是氨气,X的氢化物是硅烷,Y的氢化物是硫化物,Z的氢化物是氯化氢,则D、E、X、Y、Z分别是C、N、Si、S、Cl元素,据此答题.
解答 解:D、E、X、Y、Z是短周期元素,且原子序数逐渐增大,它们的最简单氢化物分子的空间结构依次是正四面体、三角锥形、正四面体、角形(V形)、直线型,形成正四面体结构的氢化物是甲烷或硅烷,形成三角锥型的氢化物是氨气,形成V型的氢化物是水或硫化氢,形成直线型结构的氢化物是乙炔、氟化氢或氯化氢,这几种元素的原子序数逐渐增大,所以D的氢化物是甲烷,E的氢化物是氨气,X的氢化物是硅烷,Y的氢化物是硫化物,Z的氢化物是氯化氢,则D、E、X、Y、Z分别是C、N、Si、S、Cl元素.
(1)Y最高价氧化物的化学式是SO3,Z为Cl元素,其基态原子电子排布式是1s22s22p63s23p5,
故答案为:SO3;1s22s22p63s23p5;
(2)D的最高价氧化物为CO2,与E的一种氧化物为等电子体,则E的氧化物为N2O,
故答案为:N2O;
(3)D和Y形成的化合物是CS2,其分子的空间构型和二氧化碳的相同,为直线型;分子中碳原子价层电子对数为$\frac{4+0}{2}$=2,不含孤电子对,采取sp杂化;
故答案为:直线型;sp;
(4)Y为硫元素,Z为氯元素,可以通过H2S与Cl2的反应证明氯元素的非金属性比硫元素强,相关的离子反应方程式为H2S+Cl2═2H++2Cl-+S↓,
故答案为:H2S+Cl2═2H++2Cl-+S↓;
(5)镁和氮气反应生成氮化镁,氮化镁与水反应生成两种碱,分别是氢氧化镁和氨气,所以该反应的化学方程式Mg3N2+6H2O═3Mg(OH)2+2NH3↑,
故答案为:Mg3N2+6H2O═3Mg(OH)2+2NH3↑.
点评 本题考查元素及其化合物的性质、分子空间构型等知识点,明确常见分子的空间构型是解本题的关键,会根据价层电子对互斥理论判断分子的构型及杂化方式,为高考热点.


 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:选择题
| A. | 1mol甲醇中含有C-H键的数目为4NA | |
| B. | 25℃,pH=13的NaOH溶液中含有OH-的数目为0.1NA | |
| C. | 标准状况下,2.24L己烷含有分子的数目为0.1NA | |
| D. | 1mol甲基所含的电子数目为9NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | C-C | C-H | H-H | C-O | C≡O | O-H |
| 键能/kJ•mol-1 | 348 | 413 | 436 | 358 | x | 463 |
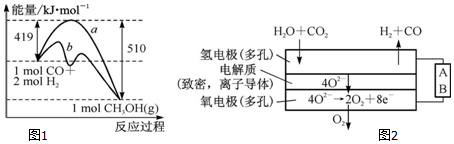
| 离子 | Cu2+ | H+ | Cl- | SO42- |
| c/mol•L-1 | 0.5 | 2 | 2 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
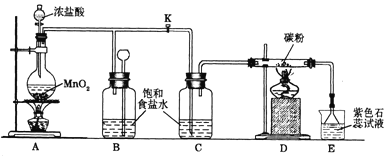
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
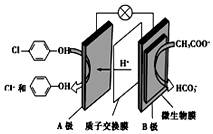 含乙酸钠和对氯酚(
含乙酸钠和对氯酚( 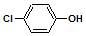 )的废水可以利用微生物电池除去,其原理如图所示:下列说法正确的是( )
)的废水可以利用微生物电池除去,其原理如图所示:下列说法正确的是( )| A. | B极是电解池的负极 | |
| B. | 电子从A极沿导线经小灯泡流向B极 | |
| C. | A极的电极反应式为: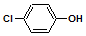 +e-═Cl-+ +e-═Cl-+ | |
| D. | 当外电路中有1 mol e-转移时,通过质子交换膜的H+为1 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾的主要成分是氢氧化铝 | B. | CH3OH可导致人体中毒 | ||
| C. | SO2可大量用于漂白食品 | D. | Na2CO3可以做胃药 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇不能与NaOH溶液反应,苯酚可以与NaOH溶液反应,说明苯环对羟基产生影响 | |
| B. | 苯不能被酸性KMnO4溶液氧化,甲苯可以被酸性KMnO4溶液氧化为苯甲酸,说明侧链对苯环产生了影响 | |
| C. | 苯与苯酚与溴水反应的条件、产物区别,说明羟基对苯环产生影响 | |
| D. | 苯和甲苯硝化反应产物的区别,说明甲基对苯环产生影响 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com