
ЁОЬтФПЁПЗДгІ2CЃЋO2===2COЕФФмСПБфЛЏШчЯТЭМЫљЪОЁЃЯТСаЫЕЗЈе§ШЗЕФЪЧ(ЁЁЁЁ)

AЁЂ12 g C(s)гывЛЖЈСПO2(g)ЗДгІЩњГЩ14 g CO(g)ЗХГіЕФШШСПЮЊ110.5 kJ
BЁЂИУЗДгІЕФШШЛЏбЇЗНГЬЪНЪЧ2C(s)ЃЋO2(g)===2CO(g)ЁЁІЄHЃНЃ221 kJ
CЁЂ2 mol C(s)гызуСПO2(g)ЗДгІЩњГЩCO2(g)ЃЌЗХГіЕФШШСПДѓгк221 kJ
DЁЂИУЗДгІЕФЗДгІШШЕШгкCOЗжзгжаЛЏбЇМќаЮГЩЪБЫљЪЭЗХЕФзмФмСПгыO2ЗжзгжаЛЏбЇМќЖЯСбЪБЫљЮќЪеЕФзмФмСПЕФВю
ЁОД№АИЁПC
ЁОНтЮіЁП
ЪдЬтЗжЮіЃКИљОнЭМЪОЃКAбЁЯюДэЮѓЃЌ12 g C(s)гывЛЖЈСПO2(g)ЗДгІЩњГЩ28 g CO(g)ЗХГіЕФШШСПЮЊ110.5 kJЃЛBбЁЯюДэЮѓЃЌІЄHЕФЕЅЮЛвЛАуЮЊkJЁЄmolЃ1ЃЈkJ/molЃЉЃЌИУЗДгІЕФШШЛЏбЇЗНГЬЪНЪЧ2C(s)ЃЋO2(g)===2CO(g) ІЄHЃНЃ221 kJЁЄmolЃ1ЃЛCбЁЯюе§ШЗЃЌ2 mol C(s)гыO2(g)ЗДгІЩњГЩCO(g)ЗХГіЕФШШСПЮЊ221 kJЃЌгЩгкCO(g)гыO2(g)ЗДгІЩњГЩCO2 (g)ЗХШШЃЌвђДЫ2 mol C(s)гызуСПO2 (g)ЗДгІЩњГЩCO2(g)ЗХГіЕФШШСПДѓгк221 kJЃЌDбЁЯюДэЮѓЃЌИУЗДгІЕФЗДгІШШЕШгкCOЗжзгжаЛЏбЇМќаЮГЩЪБЫљЪЭЗХЕФзмФмСПгыCЁЂO2ЗжзгжаЛЏбЇМќЖЯСбЪБЫљЮќЪеЕФзмФмСПЕФВюЁЃЙЪбЁCЁЃ



| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЪдМСЕФБЃДце§ШЗЕФЪЧЃЈ ЃЉ
A.Й§бѕЛЏФЦБЃДцдкГБЪЊЕФЛЗОГжаB.БЃДцNaOHЕФЪдМСЦПгУВЃСЇШћ
C.аТжЦТШЫЎБЃДцдкзиЩЋЦПжаD.Н№ЪєФЦБЃДцдкCCl4жа
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЙигкбѕЛЏЮяЕФа№Ъіе§ШЗЕФЪЧЃЈ ЃЉ
A.ЗЧН№ЪєбѕЛЏЮявЛЖЈЪЧЫсадбѕЛЏЮя
B.МюадбѕЛЏЮявЛЖЈЪЧН№ЪєбѕЛЏЮя
C.МюадбѕЛЏЮяЖМФмгыЫЎЛЏКЯЩњГЩМю
D.ЫсадбѕЛЏЮяЖМФмгыЫЎЛЏКЯЩњГЩЫс
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПНЋзуСПAgClЗжБ№ЗХШыЃКЂй5ml ЫЎЂк10mol0.2molЁЄL-1MgCl2ШмвКЂл20ml0.5molЁЄL-1NaClШмвКЂм40ml0.1molЁЄL-1бЮЫсжаШмНтжСШмвКБЅКЭЃЌИїШмвКAg+ЕФХЈЖШЗжБ№ЮЊaЁЂbЁЂcЁЂdЃЌЫќУЧгЩДѓЕНаЁЕФХХСаЫГађЪЧЃЈ ЃЉ
A. a>b>c>d B. d>b>c>a C. a>d>b>c C.c>b>d>a
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФГаЃПЮЭтаЁзщЕФЭЌбЇЩшМЦЪЕбщгУМзЭщЛЙдЖўбѕЛЏСђжЦШЁЕЅжЪСђЁЃ
ЃЈ1ЃЉМззщЭЌбЇЗжБ№РћгУШчЭМЫљЪОзАжУжЦШЁSO2 КЭCH4ЁЃ
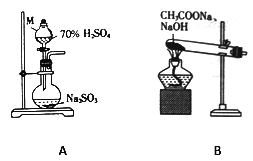
ЂйвЧЦїMЕФУћГЦЮЊ______________ЁЃ
ЂкгУAзАжУжЦБИSO2,ВЛвЫЪЙгУЯЁСђЫсЃЌЦфдвђЪЧ_________________ЁЃ
ЂлгУBзАжУжЦШЁМзЭщЕФЛЏбЇЗНГЬЪНЮЊCH3COONa+NaOH![]() CH4Ёќ+Na2CO3,ЪЕМЪЪЕбщжаГЃгУМюЪЏЛв(NaOH КЭCaOЕФЛьКЯЮя)РДДњЬцNaOHЃЌдвђЪЧ____________________________________ЁЃ
CH4Ёќ+Na2CO3,ЪЕМЪЪЕбщжаГЃгУМюЪЏЛв(NaOH КЭCaOЕФЛьКЯЮя)РДДњЬцNaOHЃЌдвђЪЧ____________________________________ЁЃ
ЃЈ2ЃЉввзщЭЌбЇРћгУМззщжЦЕУЕФCH4КЭSO2НјааЪЕбщ,ВЂбщжЄВњЮяжаГ§ЕЅжЪСђЭтЛЙКЌгаCO2ЁЃЮЊНјаабщжЄ,бЁгУМззщЪЕбщжаЕФзАжУAЁЂBКЭЯТЭМЫљЪОЕФзАжУНјааЪЕбщ,ЗЂЯжGжагаЕЛЦЩЋЙЬЬхЩњГЩ,CжаГЮЧхЪЏЛвЫЎБфЛызЧЁЃ
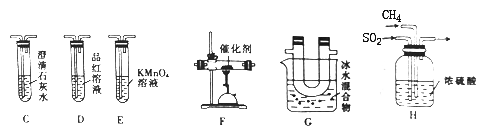
ЂйввзщЭЌбЇЕФЪЕбщзАжУжа,вРДЮСЌНгЕФКЯРэЫГађЮЊAЁЂBЁњHЁњ_____Ёњ Ёњ Ёњ Ёњ ЁЃ
ЂкEзАжУЕФзїгУЪЧ________________,GзАжУЕФзїгУЪЧ_______________ЁЃ
ЂлFзАжУжаЗЂЩњЗДгІЕФЛЏбЇЗНГЬЪНЮЊ____________________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПИљОнШчЭМЛиД№ЃЌЯТСаЫЕЗЈВЛе§ШЗЕФЪЧЃЈЁЁЁЁЃЉ

A. ШМСЯЕчГижае§МЋЗДгІЮЊ![]() O2+2eЉ+2H+ЈTH2O
O2+2eЉ+2H+ЈTH2O
B. ДЫзАжУгУгкЕчЖЦЭЪБЃЌСђЫсЭШмвКЕФХЈЖШВЛБф
C. ДЫзАжУгУгкЬњБэУцЖЦЭЪБЃЌaЮЊЬњ
D. ШєгУИУзАжУНјааДжЭЕФОЋСЖЃЌЕБга1 molЫЎЩњГЩЪБЃЌПЩЕУЕН64 gОЋЭ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁП(1)ФГЛЏбЇаЫШЄаЁзщРћгУЯТСаЪдМСЃКЬњЗлЁЂаПЗлЁЂ0.1 molЁЄL1 FeCl3ШмвКЁЂ0.1 molЁЄL1 FeCl2ШмвКЁЂKSCNШмвКЁЂаТжЦТШЫЎЃЌЬНОПFe2+ЁЂFe3+ЕФбѕЛЏадЁЂЛЙдадЃЌВЂРћгУЪЕбщНсТлНтОівЛаЉЮЪЬтЁЃ
ЂйгУЫљИјЪдМСаДГіЬхЯжFe2+ОпгаЛЙдадЕФЗДгІЕФЛЏбЇЗНГЬЪНЃК_________________________________ЁЃ
ЂкЩшМЦЪЕбщЗНАИЃЌЭъГЩЯТСаБэИёЁЃ
ЬНОПФкШн | ЪЕбщЗНАИ | ЪЕбщЯжЯѓ |
ЬНОПFe3+ОпгабѕЛЏад | ШЁЩйСП0.1 molЁЄL1 FeCl3ШмвКЃЌЭљШмвКжаМгШызуСПЬњЗлЃЌдйМгШыЩйСПKSCNШмвК | МгШыЬњЗлКѓЃЌШмвКбеЩЋБфЮЊ________ЁЃМгШыKSCNШмвККѓЃЌШмвК________ |
ЂлИУаЫШЄаЁзщЮЊЫЕУїЁАFe2+ОпгабѕЛЏадЁБЃЌЬсГіСЫЯђFeCl2ШмвКжаМгШыаПЗлЃЌЙлВьЪЕбщЯжЯѓЕФЗНАИЃЌИУЗДгІЕФРызгЗНГЬЪНЮЊ_________________________________________ЁЃ
(2)ФГЗДгІжаЗДгІЮягыЩњГЩЮягаFe3+ЁЂMn2+ЁЂH+ЁЂ![]() ЁЂH2OКЭвЛжжЮДжЊРызгXЃЌвбжЊ
ЁЂH2OКЭвЛжжЮДжЊРызгXЃЌвбжЊ![]() дкЗДгІжаЕУЕНЕчзгЃЌдђXРызгЪЧ____________ЃЌИУЗДгІЕФРызгЗНГЬЪНЪЧ____________________________ЁЃ
дкЗДгІжаЕУЕНЕчзгЃЌдђXРызгЪЧ____________ЃЌИУЗДгІЕФРызгЗНГЬЪНЪЧ____________________________ЁЃ
(3)гавЛЬњЕФбѕЛЏЮябљЦЗЃЌгУ5 molЁЄL1ЕФбЮЫс140 mLЧЁКУЭъШЋШмНтЃЌЫљЕУШмвКЛЙФмгыЭЈШыЕФ0.56 LТШЦј(БъзМзДПі)ЗДгІЃЌЪЙFe2+ШЋВПзЊЛЏЮЊFe3+ЃЌдђДЫбѕЛЏЮяЮЊ________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвЛЖЈЮТЖШЯТдквЛИі2LЕФУмБеШнЦїжаЗЂЩњЗДгІ4AЃЈsЃЉ+3BЃЈgЃЉ2CЃЈgЃЉ+DЃЈgЃЉЃЌО2minДяЦНКтзДЬЌЃЌДЫЪБBЗДгІЯћКФСЫ0.9molЃЌЯТСаЫЕЗЈе§ШЗЕФЪЧ
A. ЦНКтзДЬЌЪБAЁЂBЁЂCЁЂDЕФЗДгІЫйТЪОљЮЊ0
B. CЕФЦНОљЗДгІЫйТЪЮЊЃК0.15mol/ЃЈLminЃЉ
C. ГфШыN2ЪЙбЙЧПдіДѓПЩМгПьЗДгІЫйТЪ
D. ДЫЪБЃЌVЃЈAЃЉЃКVЃЈBЃЉЃКVЃЈCЃЉЃКVЃЈDЃЉ=4ЃК3ЃК2ЃК1
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЙ§ГЬВЛЩцМАЛЏбЇБфЛЏЕФЪЧ
A. КЃЫЎЬсфх B. ЪЏгЭСбЛЏ C. УКЕФЦјЛЏ D. ЕтЕФЩ§ЛЊ
ВщПДД№АИКЭНтЮі>>
АйЖШжТаХ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com