
【题目】某药物G的合成路线如下图所示,已知一元醇A中氧的质量分数约为26.7%,E中核磁共振氢谱为四组峰,且峰面积比为2:2:2:1。
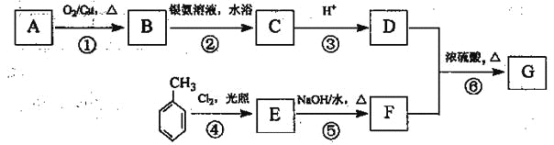
请回答下列问题:
(1)A的分子式为___ ;结构分析显示A只有一个甲基,A的名称为 。
(2)上述①~⑥步中,属于氧化反应的是___ (填序号);B中所含官能团的结构简式为__ _。
(3)写出下列反应的化学方程式:
①E→F: ;
②D+F→G: 。
(4)F所有同分异构体中,同时符合下列条件的有 种,任写出其中一种的结构简式: 。
a.分子中有6个碳原子在一条直线上;b.分子中含有一个羟基。
【答案】1)C3H8O(2分) 1-丙醇(或正丙醇)(2分)
(2)①②(2分) —CHO(1分)

【解析】
一元醇A中氧的质量分数为26.7%,设该一元醇的化学式为CnH2n+2O,氧元素的质量分数为16/(12n+2n+2+18)×100%=26.7%,得n=3,所以分子是为C3H8O,A可连续被氧化,说明B为醛,D为酸,则A应为CH3CH2CH2OH,B为CH3CH2CHO,C为CH3CH2COONH4,D为CH3CH2COOH,由反应④以及E中核磁共振氢谱为四组峰,且峰面积比为2:2:2:1,可知E为 ,F为
,F为 ,则G为
,则G为 ,结合对应物质的结构和性质以及题目要求解答该题。
,结合对应物质的结构和性质以及题目要求解答该题。
(1) 由以上分析可知A为C3H8O。结构分子显示A只有一个甲基,则A为丙醇(正丙醇)。(2)属于氧化还原反应的有①②,为醇醛的氧化反应,其他为取代反应,B为CH3CH2CHO,含有的官能团为醛基,结构简式为-CHO; (3). ①E→F的反应为 的水解反应,方程式为:
的水解反应,方程式为: ;②D+F→G的反应为酯化反应,方程式为 :
;②D+F→G的反应为酯化反应,方程式为 : 
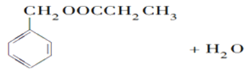 。
。
(4) F为 ,同分异构体中同时符合下列条件的有a.分子中有6个碳原子在一条直线上;b.分子中含有一个羟基。则可能的结构有
,同分异构体中同时符合下列条件的有a.分子中有6个碳原子在一条直线上;b.分子中含有一个羟基。则可能的结构有![]() ,
, ,
,![]() ,故三种结构。
,故三种结构。


 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:
【题目】能正确表示下列反应的离子方程式的是( )
A. 碳酸氢铵溶液与足量的NaOH溶液混合后加热:NH4++OH-![]() NH3↑+H2O
NH3↑+H2O
B. 向Fe(NO3)2稀溶液中加入盐酸:3Fe2++4H++NO3-=3Fe3++NO+2H2O
C. 铜片与浓HNO3:Cu+NO3-+4H+=Cu2++NO+2H2O
D. 氯化铵浓溶液跟浓NaOH溶液混合后加热:NH4++OH-![]() NH3·H2O
NH3·H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生物燃料电池(BFC)是一种真正意义上的绿色电池,其工作原理如图所示。下列说法中不正确的是

A. C2极为电池正极
B. C1极的电极反应式为:C2H5OH+3H2O-12e-=2CO2+12H+
C. 电子由C2极经外电路导线流向C1极
D. 稀硫酸中的H+向C2极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某无色透明酸性溶液,能够共存的离子组是( )
A.Al3+、NH4+、NO3﹣、Cl﹣B.Br﹣、Fe2+、Fe3+、SO42﹣
C.Na+、SO32﹣、K+、NO3﹣D.K+、Na+、I ﹣、NO3﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图甲中①②③④表示不同化学元素所组成的化合物,图乙表示由四个单体构成的化合物。以下说法不正确的是( )
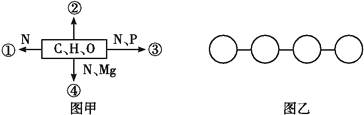
A. 若图甲中的②大量存在于皮下和内脏器官周围等部位,则②是脂肪
B. 若图甲中④能吸收、传递和转换光能,则④可用无水乙醇提取
C. 图乙中若单体是氨基酸,则该化合物彻底水解后的产物中氧原子数增加3个
D. 图乙中若单体是四种脱氧核苷酸,则该化合物彻底水解后的产物有5种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关溶液和胶体的叙述正确的是
A.氢氧化铁胶体和氯化铁溶液的本质区别为是否具有丁达尔效应
B.氯化铁溶液呈电中性,氢氧化铁胶体带有电荷
C.纳米材料的微粒一般从几纳米到几十纳米,因此纳米材料是胶体
D.氯化铁溶液能使血液凝聚沉降
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学-选修3:物质结构与性质]
铁、铜、铬、镍及其化合物在现代社会中的用途越来越广泛。
(1)铁在元素周期表中的位置是_____________,基态铁原子价电子排布式为___________。
(2)锂—磷酸氧铜电池正极的的活性物质是Cu4O(PO4)2,PO43-的空间构型是______________,P、S元素第一电离能大小关系为_______________。
(3)镍可与CO形成配合物Ni(CO)n,CO分子与N2互为等电子体,则中CO分子σ键与π键的个数比为________;该配合物的熔点是170℃,则Ni(CO)n 属于 _______晶体。
(4)在铬的摧化作用下,乙醇可被空气氧化为乙醛(CH3CHO),乙醛分子中碳原子的杂化方式是______,乙醇极易溶于水,其主要原因是_______________。
(5)立方NiO晶体结构类似于NaCl,则Ni2+的配位数为________,其晶胞边长为a cm,列式表示NiO晶体的密度为____g/cm3(不必计算出结果,阿伏加德罗常数的值为NA)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中华人民共和国国家标准(GB2760-2011)规定葡萄酒中SO2最大使用量为0.2500g·L-1。某兴趣小组用图1装置(夹持装置略)收集某葡萄酒中SO2,并对其含量进行测定。

(1)仪器A的名称是_____________________。
(2)B中加入300.00mL葡萄酒和适量盐酸,加热使SO2全部逸出并与C中H2O2完全反应,其化学方程式为________________________________。
(3)除去C中过量的H2O2,然后用0.09000mol·L-1NaOH标准溶液进行滴定,滴定前排气泡时,应选择图2中的__________________;若滴定终点时溶液的pH=8.8,则选择的指示剂为________________;若用50mL滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体的体积(填序号)________________(①=10mL,②=40mL,③<10mL,④>40mL)
(4)滴定至终点时,消耗NaOH溶液25.00mL,该葡萄酒中SO2含量为________g·L-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com