
 某兴趣小组设计出如图装置(气密性已检查),验证铜与稀硝酸反应的产物,已知:FeSO4+NO═[Fe(NO)]SO4,该反应较缓慢,待生成一定量[Fe(NO)]2+时突显明显棕色.
某兴趣小组设计出如图装置(气密性已检查),验证铜与稀硝酸反应的产物,已知:FeSO4+NO═[Fe(NO)]SO4,该反应较缓慢,待生成一定量[Fe(NO)]2+时突显明显棕色.分析 (1)实验开始时先将Y形试管向盛有碳酸钙的支管倾斜,缓慢滴入稀硝酸,碳酸钙与稀硝酸生成CO2,将整个装置内的空气赶尽,避免NO和O2反应生成NO2对气体产物的观察产生干扰;
(2)在常温下,铜片和稀硝酸反应生成硝酸铜、一氧化氮和水;
(3)本实验A生成的气体中,若有NO2,NO2溶于水生成硝酸,把Fe2+氧化成Fe3+,B瓶溶液出现血红色;若只有NO生成,FeSO4+NO═[Fe(NO)]SO4,该反应较缓慢,待生成一定量[Fe(NO)]2+时突显明显棕色.
解答 解:(1)实验开始时先将Y形试管向盛有碳酸钙的支管倾斜,缓慢滴入稀硝酸,碳酸钙与稀硝酸生成CO2,将整个装置内的空气赶尽,避免NO和O2反应生成NO2对气体产物的观察产生干扰;
故答案为:利用生成的CO2将整个装置内的空气赶尽,避免NO和O2反应生成NO2对气体产物的观察产生干扰;
(2)在常温下,铜片和稀硝酸反应生成硝酸铜、一氧化氮和水,化学方程式为3Cu+8HNO3(稀)=3Cu (NO3)2+2NO↑+4H2O,其离子方程式为:3Cu+8H++2NO3-=3Cu 2++2NO↑+4H2O;
故答案为:3Cu+8H++2NO3-=3Cu 2++2NO↑+4H2O;
(3)本实验A生成的气体中,若有NO2,NO2溶于水生成硝酸,把Fe2+氧化成Fe3+,B瓶溶液出现血红色;若只有NO生成,FeSO4+NO═[Fe(NO)]SO4,该反应较缓慢,待生成一定量[Fe(NO)]2+时突显明显棕色;
故答案为:溶液出现血红色;溶液出现棕色.
点评 本题考查了铜和硝酸的反应实验,题目难度中等,探究铜与稀硝酸反应的产物及影响反应速率的主要因素,对比、对照分析是解题的关键,侧重于考查学生实验探究能力.


科目:高中化学 来源: 题型:选择题
 ,下列关于该元素的说法错误的是( )
,下列关于该元素的说法错误的是( )| A. | 最高化合价为+7 | B. | 属于第三周期元素 | ||
| C. | 属于第 VII族元素 | D. | 单质为强还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ①②③⑤ | C. | ①②③④ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
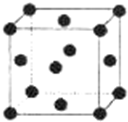 X、Y、Z、W、R.均为前四周期元素且原子序数依次增大,X的基态原子核外有7种不同运动状态的电子,Y和Z原子最外层均有2对成对电子,Z的原子序数为Y的原子序数的2倍,W3+的基态离子3d轨道为半充满状态,R的氢氧化物悬浊液可用于检验葡萄糖的存在.
X、Y、Z、W、R.均为前四周期元素且原子序数依次增大,X的基态原子核外有7种不同运动状态的电子,Y和Z原子最外层均有2对成对电子,Z的原子序数为Y的原子序数的2倍,W3+的基态离子3d轨道为半充满状态,R的氢氧化物悬浊液可用于检验葡萄糖的存在.查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L乙烷的分子数为NA | |
| B. | 1L0.1mol•L-1乙酸溶液中H+数为0.1NA | |
| C. | 23g钠的原子最外层电子数为2NA | |
| D. | 1mol甲基所含质子数为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X为0.2 mol/L | B. | Y为0.1 mol/L | ||
| C. | Z为0.4 mol/L | D. | Z为0.1 mol/L时,Y为0.4mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com