
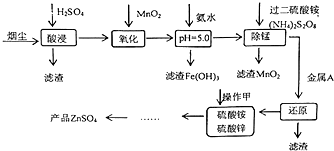
 高炉炼铁的烟尘中主要含有锌、铁、铜等金属元素.从烟尘中提取硫酸锌,可以变废为宝,减少其对环境的危害.如图是用高炉烟尘制取硫酸锌的工业流程.
高炉炼铁的烟尘中主要含有锌、铁、铜等金属元素.从烟尘中提取硫酸锌,可以变废为宝,减少其对环境的危害.如图是用高炉烟尘制取硫酸锌的工业流程.| pH | Fe3+ | Zn2+ | Mn2+ | Cu2+ |
| 开始沉淀 | 1.9 | 6.0 | 8.1 | 4.7 |
| 沉淀完全 | 3.7 | 8.0 | 10.1 | 6.7 |
| 沉淀溶解 | 不溶解 | 10.5 | 不溶解 | / |
分析 高炉炼铁的烟尘中主要含有锌、铁、铜等金属元素,用硫酸酸浸,过滤得到滤液中含有锌离子、亚铁离子、铜离子等,用二氧化锰氧化亚铁离子生成铁离子,再加氨水调节pH值使铁离子转化为氢氧化铁沉淀,过滤除去,用过二硫酸铵除去锰离子,再加入足量的锌除去铜离子,得到硫酸铵、硫酸锌的混合溶液,在溶液中加足量的( NH4)2CO3 使锌离子完全沉淀,过滤分离后用硫酸溶解得到硫酸锌.
(1)提高浸出率可从浓度、温度、搅拌等影响化学反应速率的角度分析;
(2)测量溶液pH可以用pH计;
(3)加入MnO2可以将亚铁离子氧化成铁离子;
(4)过二硫酸铵和硫酸锰反应生成二氧化锰、硫酸铵、硫酸,根据电子得失守恒和原子守恒配平书写;
(5)还原过程中锌置换出铜;
(6)使锌离子完全沉淀,要调节溶液的pH值且要不引入新的杂质;
(7)根据0.1mol.L-1Cu2+开始沉淀时pH=4.7,可计算出Ksp[Cu(OH)2],根据Ksp可计算出pH=5.0时,溶液中的Cu2+浓度的最大值.
解答 解:(1)增大硫酸浓度/升高温度/边加硫酸边搅拌/增加浸出时间等等可以提高烟尘中金属离子的浸出率,
故答案为:增大硫酸浓度/升高温度/边加硫酸边搅拌/增加浸出时间等;
(2)测量溶液pH可以用pH计(或者酸度计),
故答案为:pH计(或者酸度计);
(3)加入MnO2可以将亚铁离子氧化成铁离子,通过调节溶液pH使铁离子转化为氢氧化铁沉淀除去,
故答案为:将Fe2+氧化成Fe3+;
(4)过二硫酸铵和硫酸锰反应生成二氧化锰、硫酸铵、硫酸,反应的化学方程式为MnSO4+(NH4)2S2O8+2H2O=MnO2+(NH4)2SO4+2H2SO4,
故答案为:MnSO4+(NH4)2S2O8+2H2O=MnO2+(NH4)2SO4+2H2SO4;
(5)还原过程中锌置换出铜,反应的离子方程式为:Zn+Cu2+=Zn2++Cu,
故答案为:Zn+Cu2+=Zn2++Cu;
(6)由于在前面的步骤中已经加过锌,所以锌不能使锌离子完全沉淀,氨水与锌离子形成配合离子溶于水,氢氧化钠会引入新杂质,所以要使锌离子完全沉淀,只能用碳酸铵,
故答案为:C;
(7)根据0.1mol.L-1Cu2+开始沉淀时pH=4.7,可知Ksp[Cu(OH)2]=0.1×(10-9.3)2=10-19.6,根据Ksp可知pH=5.0时,所以溶液中的Cu2+浓度的最大值为$\frac{1{0}^{-19.6}}{(1{0}^{-9})^{2}}$mol/L=10-1.6mol/L,
故答案为:10-1.6mol/L.
点评 本题是物质制备工艺流程题目,关键是对工艺流程的理解,涉及物质的分离提纯、对原理与操作的分析评价、溶度积有关计算等,是对学生综合能力的考查,为高考常见题型,难度中等.


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:多选题
 “诺龙”属于国际奥委会明确规定的违禁药品中合成代谢类的类固醇,其结构简式如图,下列关于“诺龙”的说法中不正确的是( )
“诺龙”属于国际奥委会明确规定的违禁药品中合成代谢类的类固醇,其结构简式如图,下列关于“诺龙”的说法中不正确的是( )| A. | 既能发生加成反应,也能发生酯化反应 | |
| B. | 既能发生氧化反应,也能发生还原反应 | |
| C. | 分子式是C18H26O2 | |
| D. | 能在NaOH醇溶液中发生消去反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
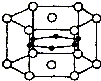 图为硼和镁两种元素组成的超导材料的晶体结构单元示意图,其中该化合物镁原子间形成正六棱柱,且棱柱的上下底面还各有1个镁原子,6个硼原子位于棱柱内.则该化合物的化学式可表示为MgB2.
图为硼和镁两种元素组成的超导材料的晶体结构单元示意图,其中该化合物镁原子间形成正六棱柱,且棱柱的上下底面还各有1个镁原子,6个硼原子位于棱柱内.则该化合物的化学式可表示为MgB2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油的分馏产物主要成分是碳氢化合物 | |
| B. | 工业上可通过石油的裂解获得大量乙烯 | |
| C. | 重油经过裂化可以得到汽油 | |
| D. | 煤中含有苯、甲苯,可用分馏的方法将它们分离 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 此溶液中Na2SO3已部分氧化? | |
| B. | 加入Ba(NO3)2溶液生成的沉淀一定含BaSO4? | |
| C. | 加HCl后的不溶沉淀一定为BaSO4? | |
| D. | 此样品未被氧化? |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com