
分析 (1)自来水中含有氯气,氯气具有强氧化性,能把含S化合物转化为硫酸根离子;
(2)①氯气与KOH反应生成KClO3、KCl和H2O;
②氧化剂得电子,还原剂失电子,根据得失电子守恒分析;
③KClO3+6HCl(浓)═KCl+3Cl2↑+3H2O中,生成3molCl2转移5mol电子;
④物质的氧化性强弱与溶液的酸碱性有关;
⑤铝离子水解生成氢氧化铝胶体能净水;
⑥a.向硫酸铝铵矾溶液NH4Al(SO4)2中滴加极少量的氢氧化钡溶液,溶液相当于铝铵矾溶液;
b.滴加氢氧化钡溶液首先与铝离子反应,所以整个过程中n(Al3+)<n(NH4+);
c.当硫酸根离子完全沉淀,则铵根离子部分反应,则铝离子全部变成氢氧化铝,而偏铝酸根离子的物质的量为0,由此分析解答;
d.溶液中硫酸钡的物质的量最大,所以不可能出现n(NH3•H2O)>n(BaSO4).
解答 解:(1)自来水中含有氯气,氯气具有强氧化性,能把含有化合物转化为硫酸根离子,所以自来水中的硫以SO42-的形态存在;
故答案为:SO42-;自来水中有Cl2,具有强氧化性;
(2)①氯气与KOH反应生成KClO3、KCl和H2O,其反应的化学方程式为:3Cl2+6KOH═5KCl+KClO3+3H2O;
故答案为:3Cl2+6KOH═5KCl+KClO3+3H2O;
②氧化剂得电子,还原剂失电子,3Cl2+6KOH═5KCl+KClO3+3H2O中,得电子的Cl为5,失电子的Cl为1,则氧化剂与还原剂的物质的量之比为5:1;
故答案为:5:1;
③KClO3+6HCl(浓)═KCl+3Cl2↑+3H2O中,生成3molCl2转移5mol电子,制取标准状况下3.36L氯气,其物质的量为$\frac{3.36L}{22.4L/mol}$=0.15mol,则转移电子为0.15mol×$\frac{5}{3}$=0.25mol,故答案为:0.25mol;
④酸性条件下发生氧化还原反应,KClO3作氧化剂,碱性条件下,氯气是氧化剂,则酸碱性不同,氯气和氯酸钾的氧化性强弱不同;
故答案为:酸碱性不同,氯气和氯酸钾的氧化性强弱不同;
⑤铝铵矾[NH4Al(SO4)2•12H2O]是常用的工业净水剂,在水中电离出铝离子,铝离子水解生成氢氧化铝胶体能净水,其水解方程式为:Al3++3H2O?Al(OH)3+3H+;
故答案为:Al3++3H2O?Al(OH)3+3H+;
⑥a.向硫酸铝铵矾溶液NH4Al(SO4)2中滴加极少量的氢氧化钡溶液,相当于铝铵矾溶液,所以离子浓度为:n(SO42-)>n(NH4+)>n(Al3+)>n(H+)>n(OH-),故a正确;
b.滴加氢氧化钡溶液首先与铝离子反应,所以整个过程中n(Al3+)<n(NH4+),故b错误;
c.当硫酸根离子完全沉淀,铵根离子部分反应,则铝离子全部变成氢氧化铝,而偏铝酸根离子的物质的量为0,所以离子物质的量大小关系为:(BaSO4)>n[Al(OH)3]>n(NH3•H2O)>n(AlO2-),故c正确;
d.NH4Al(SO4)2中,硫酸根离子的物质的量是铵根离子的2倍,则溶液中硫酸钡的物质的量最大,所以不可能出现n(NH3•H2O)>n(BaSO4),故d错误.
故答案为:ac.
点评 本题考查了氧化还原反应、物质的量的计、盐的水解、离子浓度的大小比较等,题目综合性较强,难度中等,侧重于基础知识的综合应用的考查.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 用电解法制备无机高分子聚合物--聚合氯化铝.如图所示,在一定条件下进行,电解总反
用电解法制备无机高分子聚合物--聚合氯化铝.如图所示,在一定条件下进行,电解总反| A. | Cu电极与电源正极相连 | |
| B. | 聚合氯化铝化学式中x=4 | |
| C. | 电解时阴极的电极反应式为:2H++2e?═H2↑ | |
| D. | 将电源换成导线连接两电极,则不能形成原电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用氯气从海水中提溴的关键反应是:Cl2+2Br-═2Cl-+Br2 | |
| B. | 海水中含有钾元素,只需经过物理变化就可以得到钾单质 | |
| C. | 海水中的Na+、Cl-结晶成NaCl的过程,形成了化学键 | |
| D. | 从海水中可以得到氯化镁,再经过电解可制金属镁 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NC13中N-C1键键长比CCl4中C-C1键键长短 | |
| B. | NC13分子中的所有原子均达到8电子稳定结构 | |
| C. | NCl3分子是极性分子 | |
| D. | NBr3的沸点比NCl3的沸点低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中,Na+、H+、Cl-、NO3-可以大量共存 | |
| B. | 和新制氯水反应的离子方程式:Fe2++Cl2=Fe3++2Cl- | |
| C. | 加入NaOH溶液至Fe2+刚好沉淀完全的离子方程式:Fe2++2OH-=Fe(OH)2↓ | |
| D. | 离子浓度关系:c(SO42-)=c(NH4+ )>c(Fe2+ )>c(H+ )>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | W、X、Y形成的简单离子,其半径大小关系为W>X>Y | |
| B. | M、W元素形成的简单氢化物的稳定性:W>M | |
| C. | X是同周期中金属性最强的元素 | |
| D. | Z的最高价氧化物对应的水化物的浓溶液能与Y的单质在常温下剧烈反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
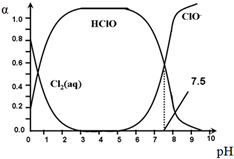 氯在饮用水处理中常用作杀菌剂,且HClO的杀菌能力比ClO-强.25℃时氯气-氯水体系中存在以下平衡关系:
氯在饮用水处理中常用作杀菌剂,且HClO的杀菌能力比ClO-强.25℃时氯气-氯水体系中存在以下平衡关系:| A. | Cl2(g)+H2O?2H++ClO-+Cl- K=10-10.9 | |
| B. | pH=7.5时,用氯处理饮用水体系中,c(Cl-)+c(HClO)=c(H+)-c(OH-) | |
| C. | 用氯处理饮用水时,pH=6.5时杀菌效果比pH=4.5时好 | |
| D. | 氯处理饮用水时,在夏季的杀菌效果比在冬季好 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com