
(5分)称取含CaCO3 60%的试样0.25g,用酸溶解后加入过量(NH4)2C2O4,使Ca2+沉淀为CaC2O4。在过滤、洗涤沉淀时,为了使沉淀溶解损失造成的误差不大于万分之一,应该用100mL质量百分比浓度至少为多少的(NH4)2C2O4作洗涤液?已知溶液中当Ca2+和C2O42―离子物质的量浓度的乘积等于或大于2.3×10-9时会析出CaC2O4沉淀。
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:阅读理解
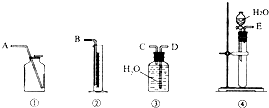 现有含CaO杂质的CaC2试样.某研究性学习小组的同学拟用以下三种方案测定CaC2试样的纯度.请填写下列空白:
现有含CaO杂质的CaC2试样.某研究性学习小组的同学拟用以下三种方案测定CaC2试样的纯度.请填写下列空白:| 读数次数 | 质量/g | |
| 锥形瓶+水+试样 | 第1次 | 196.30 |
| 第2次 | 196.15 | |
| 第3次 | 196.05 | |
| 第4次 | 196.00 | |
| 第5次 | 196.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃物质 | 0 | 20 | 30 | 45 | 60 | 80 |
| Sr(NO3)2 | 28.2 | 40.7 | 47 | 47.2 | 48.3 | 49.2 |
| Ca(NO3)2?4H2O | 102 | 129 | 152 | 230 | 300 | 358 |
| O | 2- 3 |
| O | 2- 3 |
查看答案和解析>>
科目:高中化学 来源:2013届福建省安溪一中高三上学期期末考试化学试卷(带解析) 题型:填空题
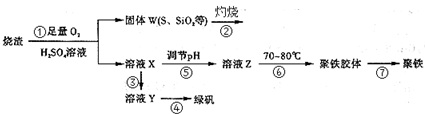
(14分)实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4·7H2O),过程如下: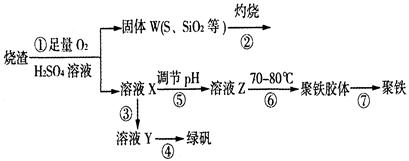
(1)将过程②中的产生的气体通入下列溶液中,溶液会褪色的是 ;
A.品红溶液 B.紫色石蕊溶液 C.酸性KMnO4溶液 D.溴水
(2)过程①中,FeS和O2、H2SO4反应的化学方程式为: ;
(3)过程③中,需加入的物质是 ;
(4)过程④中,蒸发结晶需要使用酒精灯、三角架、泥三角,还需要的仪器有
;
(5)过程⑤调节pH可选用下列试剂中的 (填选项序号);
A.稀硫酸 B.CaCO3 C.NaOH溶液
(6)过程⑥中,将溶液Z加热到70一80℃,目的是 ;
(7)实验室为测量所得到的聚铁样品中铁元素的质量分数,进行下列实验。①用分析天平称取2.00g样品;②将样品溶于足量的盐酸后,加入过量的氯化钡溶液;③过滤、洗涤、干燥,称量,得固体质量为2.33g。若该聚铁主要成分为[(Fe(OH)(SO4)]n,则该聚铁样品中铁元素的质量分数为 。(假设杂质中不含铁元素和硫元素)。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年山东济宁汶上一中高一12月月考化学试卷 题型:实验题
(15分) 在呼吸面具和潜水艇中可用过氧化钠作供氧剂,某课外活动小组设计了如下实验装置,以证明过氧化钠可作供氧剂。装置A、B、C中盛装的试剂,可供选择的为:饱和NaHCO3溶液、CaCO3固体、NaOH溶液、1.95 g Na2O2固体。 据下述装置回答问题: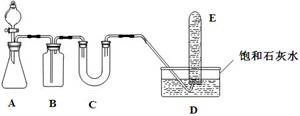
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com