


 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案科目:高中化学 来源: 题型:
根据下列框图回答问题(答题时,方程式中的M、E用所对应的元素符号表示):

(1)写出M溶于稀H2SO4和H2O2混合液的化学方程式: 。
(2)某同学取X的溶液,在空气中放置一段时间后用酸酸化,再加入KI淀粉溶液,发现溶液变为蓝色。写出与上述变化过程相关的离子方程式:
、 。
(3)写出Cl2将Z氧化为K2EO4的化学方程式: 。
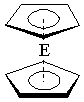 (4)由E制备的E(C5H5)2的结构如右图,其中氢原子的化学环境
(4)由E制备的E(C5H5)2的结构如右图,其中氢原子的化学环境
![]()
完全相同。但早期人们却错误地认为它的结构为: 。
核磁共振法能够区分这两种结构。在核磁共振氢谱中,正确的结构
有 种峰,错误的结构有 种峰。
(5)在1L 1mol/L的稀硝酸中加入0.3 mol金属E (还原产物只有NO),充分反应后,请简述检验溶液中的金属阳离子的实验操作及现象
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com