
 (1)经分析,某芳香族化合物A含C、H、O的质量分数分别为77.8%、7.4%、14.8%,该有机物一个分子中只含有一个氧原子.
(1)经分析,某芳香族化合物A含C、H、O的质量分数分别为77.8%、7.4%、14.8%,该有机物一个分子中只含有一个氧原子.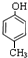 ;
;分析 (1)由氧元素质量分数与氧原子数目计算有机物的相对分子质量,再结合C、H元素质量分数计算分子中C、H原子数目,进而确定有机物的分子式;
如果该有机物遇FeCl3溶液会变紫色,含有酚羟基,结合有机物的分子式书写可能的结构简式;若该有机物能与钠反应放出气体,但遇FeCl3不显色,则含有醇羟基,该有机物与乙酸、浓硫酸共热条件下发生酯化反应;
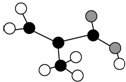
(2)只含C、H、O三种元素的某有机物分子模型如图所示,由碳原子形成4个共价键的特点可知有机物为CH2=C(CH3)COOH.
解答 解:(1)①某芳香族化合物经分析含有C、H、O的质量分数为77.7%、7.4%、14.8%,该有机物一个分子只含1个氧原子,则有机物的相对分子质量=$\frac{16}{14.8%}$=108,分子中C原子数目=$\frac{108×77.8%}{12}$=7、H原子数目=$\frac{108-12×7-16}{1}$=8,则该化合物的分子式为C7H8O,
故答案为:C7H8O;
②如果该有机物遇FeCl3溶液会变紫色,含有酚羟基,还含有一个甲基,可能的结构简式有: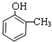 、
、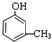 、
、 ,核磁共振氢谱中有四个峰,该有机物的结构简式为
,核磁共振氢谱中有四个峰,该有机物的结构简式为 ,
,
故答案为: ;
;
③若该有机物能与钠反应放出气体,但遇FeCl3不显色,则含有醇羟基,应为C6H5CH2OH,该有机物与乙酸、浓硫酸共热条件下发生酯化反应,
方程式为CH3COOH+C6H5CH2OH$→_{△}^{浓硫酸}$CH3COOCH2C6H5+H2O,
故答案为:CH3COOH+C6H5CH2OH$→_{△}^{浓硫酸}$CH3COOCH2C6H5+H2O;
(2)只含C、H、O三种元素的某有机物分子模型如图所示,由碳原子形成4个共价键的特点可知有机物为CH2=C(CH3)COOH,分子中含有碳碳双键、羧基,对应的含有相同官能团,且分子中不含甲基的同分异构体为 CH2=CH-CH2-COOH,
故答案为:CH2=C(CH3)COOH;羧基;CH2=CH-CH2-COOH.
点评 本题考查有机物推断,为高频考点,侧重于学生的分析、计算能力的考查,把握分子模型判断结构以及有机物的结构和性质的关系,题目难度不大.


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:选择题
| A. | H2F+的电子式: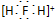 | |
| B. | 铝离子的结构示意图: | |
| C. | 质子数为35、中子数为45的溴原子:${\;}_{35}^{45}$Br | |
| D. | 丙烷分子的球棍模型: |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
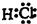 ;反应③中被破坏的化学键属于非极性键(填“极性”或“非极性”).
;反应③中被破坏的化学键属于非极性键(填“极性”或“非极性”).查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
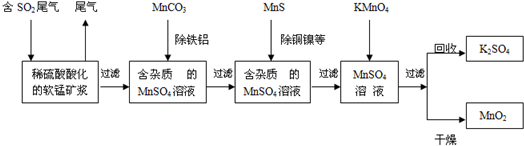
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
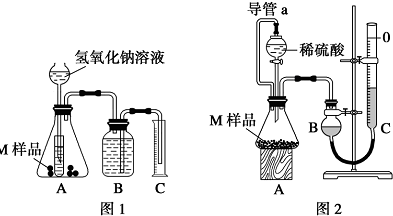
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 乙二酸俗名草酸,下面是化学学习小组的同学对草酸晶体(H2C2O4•xH2O)进行的探究性学习的过程,请你参与并协助他们完成相关学习任务.该组同学的研究课题是:探究测定草酸晶体(H2C2O4•xH2O)中x值.通过查阅资料和网络查寻得,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定:学习小组的同学设计了滴定的方法测定x值.
乙二酸俗名草酸,下面是化学学习小组的同学对草酸晶体(H2C2O4•xH2O)进行的探究性学习的过程,请你参与并协助他们完成相关学习任务.该组同学的研究课题是:探究测定草酸晶体(H2C2O4•xH2O)中x值.通过查阅资料和网络查寻得,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定:学习小组的同学设计了滴定的方法测定x值.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝合金的大量使用归功于人们能使用焦炭等还原剂从氧化铝中获得铝 | |
| B. | “天宫一号”使用的碳纤维是一种新型有机高分子材料 | |
| C. | 将苦卤浓缩、氧化、鼓入热空气或水蒸气提取海水中的溴 | |
| D. | 为防止中秋月饼等富脂食品因被氧化而变质,常在包装袋中放入生石灰或硅酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com