
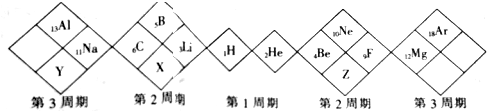
| A. | X元素最高价氧化物对应的水化物为弱酸 | |
| B. | Y元素最外层电子数是最内层电子数的2倍 | |
| C. | 原子半径:Y>X>Z | |
| D. | X、Y、Z的气态氢化物中最稳定的是X的氢化物 |
分析 设计的元素周期表中,以H为起点,原子序数按逆时针顺序增大,可知X为N元素、Z为O元素、Y为P元素.
A.硝酸属于强酸;
B.Y为P元素,最外层电子数为5,最内层电子数为2;
C.同周期随原子序数增大,原子半径减小,同主族自上而下原子半径增大;
D.非金属性越强,对应氢化物越稳定.
解答 解:设计的元素周期表中,以H为起点,原子序数按逆时针顺序增大,可知X为N元素、Z为O元素、Y为P元素.
A.X为N元素,最高价氧化物对应的水化物硝酸,属于强酸,故A错误;
B.Y为P元素,最外层电子数为5,最内层电子数为2,最外层电子数是最内层电子数的2.5倍,故B错误;
C.同周期随原子序数增大,原子半径减小,同主族自上而下原子半径增大,故原子半径:Y(P)>X(N)>Z(O),故C正确;
D.非金属性Y(P)<X(N)<Z(O),非金属性越强,对应氢化物越稳定,故D错误,
故选:C.
点评 本题考查元素周期表与元素周期律,关键是读懂题目中元素周期表编排,注意对元素周期律的掌握,难度中等.


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:选择题
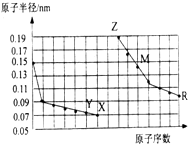
| A. | 简单离子的半径大小比较:Z>Y>X | |
| B. | 气态氢化物稳定性:Y>X>R | |
| C. | 单质的熔点:M>Z | |
| D. | Z单质能从M的盐溶液中置换出单质M |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.5g | B. | 3g | C. | 5g | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在标准状况下,22.4L SO3的分子数约为NA个 | |
| B. | 58.5g NaCl溶于1 L水中,所得溶液中溶质的物质的量浓度为1 mol/L | |
| C. | 常温、常压下,48g臭氧含有的氧原子数为3NA | |
| D. | 5.6g Fe与足量的盐酸反应失去的电子数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
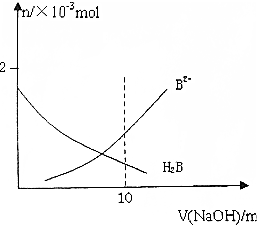 常温下,向10mL 0.2mol/L H2B溶液中滴加0.2mol/L NaOH溶液.溶液中H2B和B2-的物质的量变化如图,根据图示判断,下列说法正确的是( )
常温下,向10mL 0.2mol/L H2B溶液中滴加0.2mol/L NaOH溶液.溶液中H2B和B2-的物质的量变化如图,根据图示判断,下列说法正确的是( )| A. | 当V(NaOH)=10mL时,溶液中有关粒子浓度大小关系为:c(Na+)>c(B2-)>c(HB-)>c(H2B)>c(OH-) | |
| B. | 等体积等浓度的NaOH溶液与H2B溶液混合后其溶液中,水的电离程度被促进 | |
| C. | 向NaHB溶液中加水稀释,溶液中c(Na+),c(B2-),c(HB-),c(OH-)均减小 | |
| D. | 当V(NaOH)=10mL时,溶液中存在下列关系c(H2B)+c(H+)=c(OH-)+c(B2-) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
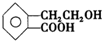 ,它可通过不同化学反应分别制得B、C、D和E四种物质.
,它可通过不同化学反应分别制得B、C、D和E四种物质.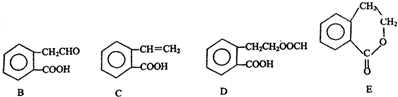
 +O2$→_{△}^{催化剂}$2
+O2$→_{△}^{催化剂}$2 +2H2O.
+2H2O.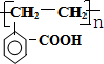 .
.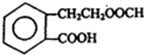 +2NaOH$\stackrel{△}{→}$HCOONa+
+2NaOH$\stackrel{△}{→}$HCOONa+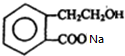 +2H2O.
+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去氯化钾中混有的KI:溶于水通入过量氯气,蒸发结晶 | |
| B. | 除去Na2CO3固体中混有的NaHCO3:加热至恒重 | |
| C. | 除去食盐中的泥沙:溶于水,过滤,滤液蒸发结晶 | |
| D. | 从溴水中提取溴单质:加入酒精萃取 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com