
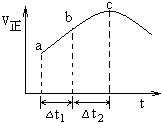
 向绝热恒容密闭容器中通入SO2和NO2,在一定条件下使反应SO2(g)+NO2(g)═SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示.由图可得出的正确结论是( )
向绝热恒容密闭容器中通入SO2和NO2,在一定条件下使反应SO2(g)+NO2(g)═SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示.由图可得出的正确结论是( )| A. | 该反应为放热反应 | |
| B. | 反应物浓度:c>b>a | |
| C. | a、b均未建立平衡,c点恰好达到平衡 | |
| D. | 若在恒温恒容容器中,以相同的投料进行该反应,平衡后转化率小于绝热恒容容器中的转化率 |
分析 由题意可知一个反应前后体积不变的可逆反应,由于容器恒容,因此压强不影响反应速率,所以在本题中只考虑温度和浓度的影响.结合图象可知反应速率先增大再减小,因为只要开始反应,反应物浓度就要降低,反应速率应该降低,但此时正反应却是升高的,这说明此时温度的影响是主要的,由于容器是绝热的,因此只能是放热反应,从而导致容器内温度升高反应速率加快,平衡逆向进行.
解答 解:A、从a到c正反应速率增大,之后正反应速率减小,说明反应刚开始时温度升高对正反应速率的影响大于浓度减小对正反应速率的影响,说明该反应为放热反应,即反应物的总能量高于生成物的总能量,故A正确;
B、a到b时正反应速率增加,反应物浓度随时间不断减小,c<b<a,故B错误;
C、化学平衡状态的标志是各物质的浓度不再改变,其实质是正反应速率等于逆反应速率,c点对应的正反应速率显然还在改变,故一定未达平衡,故C错误;
D、若在恒温恒容容器中,以相同的投料进行该反应,随着反应的进行,正反应速率越快,消耗的二氧化硫就越多,反应物的转化率将逐渐增大,分析可知反应是放热反应,绝热恒容容器中随温度升高,平衡逆向进行,反应物的转化率减小,所以若在恒温恒容容器中,以相同的投料进行该反应,平衡后转化率大于绝热恒容容器中的转化率,故D错误;
故选A.
点评 本题考查化学反应速率和平衡图象,注意该反应的特点及反应限制条件,一定要读懂,“绝热恒容密闭容器”这句话表达的含义,难度较大.


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:选择题
| A. | NaHCO3=Na++HCO3- | B. | H2SO4?2H++SO42- | ||
| C. | NaHSO3=Na++H++SO32- | D. | 熔融状态下:NaHSO4=Na++H++SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
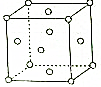 X、Y、Z、W、R是元素周期表前四周期元素中的五种常见元素,其原子序数依次增大.X的基态原子的最外层电子排布式为nsnnpn+1.Y、Z同主族且ZY2是导致酸雨的主要物质之一.R位于ds区且原子最外层只有一个电子.W原子次外层电子数为最外层电子数的7倍.请回答下列问题:
X、Y、Z、W、R是元素周期表前四周期元素中的五种常见元素,其原子序数依次增大.X的基态原子的最外层电子排布式为nsnnpn+1.Y、Z同主族且ZY2是导致酸雨的主要物质之一.R位于ds区且原子最外层只有一个电子.W原子次外层电子数为最外层电子数的7倍.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | .①②③ | B. | ②③ | C. | ① | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓H2SO4 | B. | 饱和NaCl溶液 | C. | NaOH溶液 | D. | NaBr溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
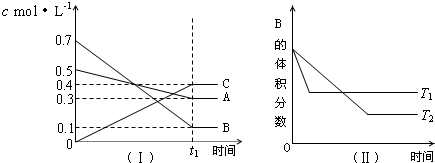
| A. | 在(t1+10)min时,保持其他条件不变,增大压强,平衡向逆反应方向移动 | |
| B. | (t1+10)min时,保持容器总压强不变,通入稀有气体,平衡向逆反应方向移动 | |
| C. | 其他条件不变,升高温度,正、逆反应速率均增大,且A的转化率增大 | |
| D. | 由图(Ⅱ)可知,T1>T2,且该正反应为吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将标准状况下的2.24L CO2通入150mL 1mol•L-1 NaOH溶液中,所得溶液中c(CO32-)>c(HCO3-) | |
| B. | 常温下0.1 mol•L-1的下列溶液①NH4Al(SO4)2 ②NH4Cl ③NH3•H2O④CH3COONH4中,c(NH4+)由大到小的顺序是:②>①>④>③ | |
| C. | 0.1 mol•L-1 pH为9的NaHB溶液中:c(HB-)>c(B2-)>c(H2B) | |
| D. | 室温下,将0.4mol/L HA溶液和0.2mol/LNaOH溶液等体积混合(忽略混合时溶液体积的变化)测得混合液pH=5,则c(A-)+c (OH-)>c(H+)+c(HA) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{34}^{78}Se$和${\;}_{34}^{80}Se$不是同一种元素 | |
| B. | ${\;}_{34}^{78}Se$和${\;}_{34}^{80}Se$互为同位素 | |
| C. | ${\;}_{34}^{78}Se$和${\;}_{34}^{80}Se$分别含有44和46个质子 | |
| D. | ${\;}_{34}^{78}Se$和${\;}_{34}^{80}Se$都含有34个中子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com