

| A. | ①⑤⑥ | B. | ②④⑦ | C. | ①⑥⑦ | D. | ⑤⑥⑦ |
 一课一练课时达标系列答案
一课一练课时达标系列答案 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:解答题
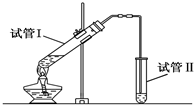 实验室用如图所示装置制备少量乙酸乙酯.
实验室用如图所示装置制备少量乙酸乙酯. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | C在O2充足时,发生的反应主要是放热反应 | |
| B. | 煤燃烧时吹入的氧气越多越好 | |
| C. | CO2+C$\frac{\underline{\;高温\;}}{\;}$2CO这一反应属于吸热反应 | |
| D. | 煤燃烧时,反应物自身总能量高于生成物总能量,所以放出热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
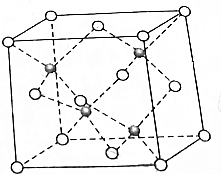 Cu与F形成的化合物的晶胞结构如图所示,若晶体密度为ag•cm-3,则Cu与F最近距离为$\frac{\sqrt{3}}{4}$×$\root{3}{\frac{4×83}{{aN}_{A}}}$×1010 pm.(阿伏加德罗常数用NA表示,列出计算表达式,不用化简:图中○为Cu,
Cu与F形成的化合物的晶胞结构如图所示,若晶体密度为ag•cm-3,则Cu与F最近距离为$\frac{\sqrt{3}}{4}$×$\root{3}{\frac{4×83}{{aN}_{A}}}$×1010 pm.(阿伏加德罗常数用NA表示,列出计算表达式,不用化简:图中○为Cu, 为F)
为F)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
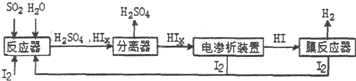
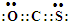 .
.
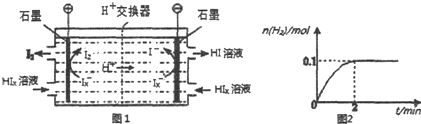
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com