
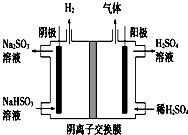
 工业上用Na2SO3吸收尾气中的SO2,再用如图装置电解(惰性电极)NaHSO3制取H2SO4,阴极电极反应式2H++2e-=H2↑,阳极区逸出气体的成分为O2 SO2(填化学式).
工业上用Na2SO3吸收尾气中的SO2,再用如图装置电解(惰性电极)NaHSO3制取H2SO4,阴极电极反应式2H++2e-=H2↑,阳极区逸出气体的成分为O2 SO2(填化学式).  阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 机身隔框一般采用超硬铝,承受较大载荷的加强框采用高强度结构钢或钛合金 | |
| B. | 航空发动机对材料的要求非常高,所以其气缸必须使用纯度相当高的金属材料 | |
| C. | 很多飞机的机载雷达装在机身头部,一般采用玻璃纤维增强塑料做成的头锥将机身头部罩住以便能透过电磁波 | |
| D. | 采用特殊的新型复合材料作为表面涂层,使其几乎不反射雷达所发出的电磁波,雷达就检测不到 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
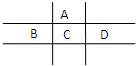 有A、B、C、D、E五种短周期元素,且相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示.E的氢氧化物是两性氢氧化物,E的阳离子与A的阴离子核外电子层结构相同.
有A、B、C、D、E五种短周期元素,且相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示.E的氢氧化物是两性氢氧化物,E的阳离子与A的阴离子核外电子层结构相同.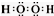 ,分子中所含共价键的类型为极性键、非金属性键.
,分子中所含共价键的类型为极性键、非金属性键.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl | B. | H2SO4 | C. | AgNO3 | D. | Na2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)在室温下测得0.1mol•L-1氨水PH=11,则该温度下氨水的电离度α=1.0%
(1)在室温下测得0.1mol•L-1氨水PH=11,则该温度下氨水的电离度α=1.0%查看答案和解析>>
科目:高中化学 来源: 题型:解答题
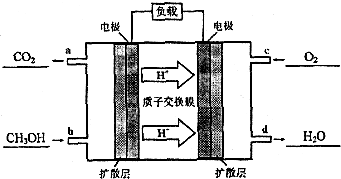
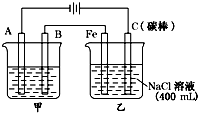 如图为相互串联的甲乙两电解池.试回答:
如图为相互串联的甲乙两电解池.试回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉碘化钾溶液在空气中变蓝:4I+O2+2H2O═4OH-+2I2 | |
| B. | 用NaOH溶液吸收氯气:2OH-+2Cl2═2Cl-+H2O | |
| C. | 少量CO2通入苯酚钠溶液中:2C6H5O-+CO2+H2O→2C6H5OH+CO32- | |
| D. | 氯化镁溶液与氨水反应:Mg2++2OH-═Mg(OH)2↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
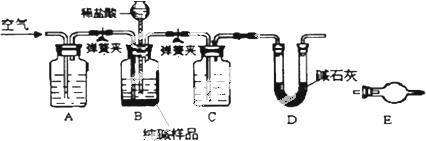
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com