
 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:






查看答案和解析>>
科目:高中化学 来源: 题型:
(7分))如图是氯化钠的晶胞示意图,回答如下问题:
(1)在NaCl晶体中,与每个Cl-距离等同且距离最近的几个Na+所围成的空间几何构型为__________。
A.正四面体 B.正六面体 C.正八面体 D.正十二面体
(2)NaCl晶体中不存在分子,但是当温度达到1686 K时,NaCl晶体形成气体,并以分子形式存在。现有29.25 g NaCl晶体,强热使其气化,测的气体体积为5.6 L(已折算成标准状况)则此时氯化钠气体的化学式为_____________。
(3)随着科学技术的发展,阿伏加德罗常数的测定手段越来越多,测定的精确度也越来越高。现有一种简单可行的测定方法,具体步骤为:
①将固体NaCl细粒干燥后,准确称取a g NaCl固体并转移到定容容器A中;
②用滴定管向A仪器中加苯,不断振荡,继续加苯至A仪器的刻度,计算出NaCl固体的体积为V cm3。步骤①中A仪器最好使用_______________。
A.量筒 B.烧杯 C.容量瓶 D.试管
(4)已知NaCl晶体中,距离最近的Na+与Cl-间的平均距离为b cm,用上述测定方法测得的阿伏加德罗常数NA的表达式为______________________。(用含V、a、b的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
(化学方程式2分,其余每空1分,共10分)
(1)在NaCl溶液中滴加AgNO3溶液,现象为_____________________________,
反应的离子方程式为:_________________________________________________
(2)在CH3CH2CH2Cl中滴加AgNO3溶液,现象为_______________________________,
原因是__________________________
(3)若先将CH3CH2CH2Cl与NaOH溶液共热,然后用硝酸酸化,再滴加AgNO3溶液,现象为_______________________________________________________,反应的化学方程式为:
___________________________________、______________________________________。
查看答案和解析>>
科目:高中化学 来源:09~10年黄冈中学高一下学期期末考试化学卷 题型:填空题
(10分)由阴阳离子通过离子键结合而成的晶体称为离子晶体,离子化合物固态时一般为晶体,在离子晶体中,阴、阳离子按一定规律在空间排列。下图是NaCl晶体的晶胞结构。(空心点为Cl—,实心球为Na+)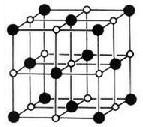
(1)在NaCl晶体中,每个Na+离子同时吸引着_______个Cl—离子,在周围与它最接近且等距离的Cl—共有___________个,Cl—离子位于Na+围成的___________体中心,而Na+离子数目与Cl-离子数目之比为___________。
(2)若CuO晶体中O2-采取NaCl晶胞结构中Na+的堆积方式,Cu2+占据O2-围成的正四面体空隙,则Cu2+占据O2-围成的正四面体空隙的占据率为 __________。
在离子晶体中,阴、阳离子具有或接近具有球形对称的电子云,它们可以被看成是不等径的刚性圆球,并彼此相切(如下图),离子键的键长是相邻阴、阳离子的半径之和(如下图)。已知a为常数。试回答下列问题: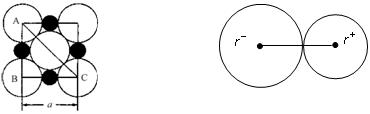
NaCl晶体中微粒间排布 NaCl晶体中离子键键长
(3)NaCl晶体离子键的键长为____________。
(4)Na+离子半径与Cl-离子半径之比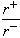 =_______________。
=_______________。
(已知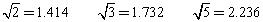 )
)
(5)NaCl晶体中不存在分子,但在温度达到1413℃时,NaCl晶体形成气体,并以分子形成存在,现在29.25g NaCl晶体,强热使温度达到1450℃,测得气体体积为5.6L(已折算为标准状况),则此时氯化钠气体的分子式(化学式)为____________。
查看答案和解析>>
科目:高中化学 来源:2010年河北省唐山一中高二第二学期期末考试化学试卷 题型:填空题
(7分))如图是氯化钠的晶胞示意图,回答如下问题:
(1)在NaCl晶体中,与每个Cl-距离等同且距离最近的几个Na+所围成的空间几何构型为__________。
A.正四面体 B.正六面体 C.正八面体 D.正十二面体
(2)NaCl晶体中不存在分子,但是当温度达到1686 K时,NaCl晶体形成气体,并以分子形式存在。现有29.25 g NaCl晶体,强热使其气化,测的气体体积为5.6 L(已折算成标准状况)则此时氯化钠气体的化学式为_____________。
(3)随着科学技术的发展,阿伏加德罗常数的测定手段越来越多,测定的精确度也越来越高。现有一种简单可行的测定方法,具体步骤为:
①将固体NaCl细粒干燥后,准确称取a g NaCl固体并转移到定容容器A中;
②用滴定管向A仪器中加苯,不断振荡,继续加苯至A仪器的刻度,计算出NaCl固体的体积为V cm3。步骤①中A仪器最好使用_______________。
A.量筒 B.烧杯 C.容量瓶 D.试管
(4)已知NaCl晶体中,距离最近的Na+与Cl-间的平均距离为b cm,用上述测定方法测得的阿伏加德罗常数NA的表达式为______________________。(用含V、a、b的代数式表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com