
【题目】0.5mol某羧酸与足量乙醇发生酯化反应,生成酯的质量比原羧酸的质量增加了28g,则原羧酸可能是
A. 甲酸 B. 乙二酸 C. 丙酸 D. 丁酸
科目:高中化学 来源: 题型:
【题目】A~G都是有机化合物,它们的转化关系如下:
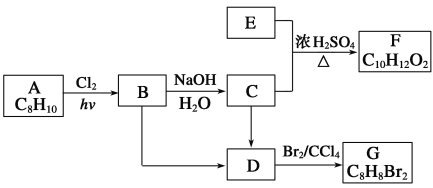
请回答下列问题:
(1)已知:6.0 g化合物E完全燃烧生成8.8 g CO2和3.6 g H2O;E的蒸气与氢气的相对密度为30,则E的分子式为 。
(2)A为一取代芳香烃,B中含有一个甲基。由B生成C的化学方程式为______________。
(3)由B生成D的反应条件是 ;由C生成D的反应类型是 。
(4)F存在于栀子香油中,其结构简式为________________________。
(5)在G的同分异构体中,苯环上一硝化的产物只有一种的共有 种,其中核磁共振氢谱有两组峰,且峰面积比为1∶1的是___________________(填结构简式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚铁氰化钾K4[Fe(CN)6],俗名黄血盐,可溶于水,不溶于乙醇。在化学实验、电镀、食品添加剂、烧制青花瓷时可用于绘画等方面有广泛用途。已知HCN是一种极弱的酸,现有一种用含NaCN的废水合成黄血盐的主要工艺流程如下:
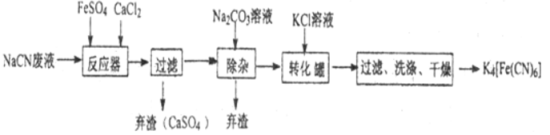
(1)常温下,NaCN水溶液的pH 7(填“>”、“<”、“ = ”),实验室用NaCN固体配制NaCN溶液时,应先将其溶于 溶液,再用蒸馏水稀释。
(2)反应器中发生的主要反应的化学方程式为 。
(3)流程中加入Na2CO3溶液后过滤除去弃渣,过滤需要的玻璃仪器有烧杯、漏斗、 。
(4)转化器中生成K4[Fe(CN)6]的反应类型是 ,相同温度下,溶解度:K4[Fe(CN)6] Na4[Fe(CN)6](填“>”“ = ”“<”),过滤后洗涤K4[Fe(CN)6]使用的试剂是 。
(5)实验室常用K4[Fe(CN)6]检验Fe3+,生成难溶盐KFe[Fe(CN)6],试写出上述反应的离子方程式为 。
(6)含有14.7kgNaCN的工业废水可生产出9.2kg的K4[Fe(CN)6],则K4[Fe(CN)6]的产率是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A.Fe(NO3)2溶液中滴入一定量盐酸:3Fe2++4H++NO3-=2H2O+NO↑+3Fe3+
B.向氯化铵的溶液中加入足量浓NaOH溶液并加热:NH4++OH-![]() NH3·H2O
NH3·H2O
C.Ba(OH)2溶液与H2SO4溶液混合产生沉淀:Ba2++ SO42-=BaSO4↓
D.往NaOH溶液中通入过量SO2:SO2+2OH-=SO32- +H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的说法正确的是( )
A.钠跟乙醇反应比跟水反应剧烈
B.有机物ClCH2COOH中含有两种官能团
C.将苯与浓硝酸、浓硫酸共热以制取苯磺酸
D.将乙烷和氯气混合后光照制备纯净的氯乙烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知铁生锈的过程为:Fe → Fe(OH)2 → Fe(OH)3 → Fe2O3·xH2O。又知草酸(H2C2O4)分解产生CO等气体某化学小组为测定两种不同生锈铁片的组成(设只含有铁和Fe2O3·xH2O),进行了以下探究,请你参与并完成对有关问题的解答。
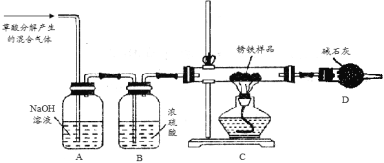
(1)甲同学利用草酸分解产生的混合气体和下图所示装置测定其中一种锈铁的组成。
主要操作为:取锈铁样品12.6 g置于装置C的硬质玻璃管中,加热完全反应后得到固体的质量为8.4 g,装置D增重8.4 g。
草酸(H2C2O4)分解的化学方程式为 。
(2)乙同学在甲同学装置的基础上将装置D换成装浓硫酸的洗气瓶(装置E,此装置图略),经改进后,重新按甲同学的操作和样品取用量进行实验,若完全反应后得到固体的质量仍为8.4 g,而装置E增重1.8 g,则x = ;m(Fe):m (Fe2O3·xH2O) =
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学用语是学习化学的工具和基础。下列有关化学用语的使用正确的是( )
A.用食醋除去水壶内的水垢:CaCO3+2H+=Ca2++CO2↑+H2O
B.纯碱溶液呈碱性的原因是:CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
C.钢铁发生吸氧腐蚀的正极反应式:O2+4e-+2H2O=4OH-
D.表示氢气燃烧热的热化学方程式为2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ· mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙微溶于水,溶于酸,可作分析试剂、医用防腐剂、消毒剂。以下是一种制备
过氧化钙的实验方法。回答下列问题:
(一)碳酸钙的制备

步骤①加入氨水的目的是________________。小火煮沸的作用是使沉淀颗粒长大,有利于__________________。
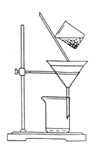
(2)如图是某学生的过滤操作示意图,其操作不规范的是_________(填标号)。
a.漏斗末端颈尖未紧靠烧杯壁
b.玻璃棒用作引流
c.将滤纸湿润,使其紧贴漏斗壁
d.滤纸边缘高出漏斗
e.用玻璃棒在漏斗中轻轻搅动以加快过滤速度
(二)过氧化钙的制备
![]()
(3)步骤②的具体操作为逐滴加入稀盐酸,至溶液中尚存有少量固体,此时溶液呈_______性(填“酸”、“碱”或“中”)。将溶液煮沸,趁热过滤。将溶液煮沸的作用是______________。
(4)步骤③中反应的化学方程式为____________________。
(5)将过滤得到的白色结晶依次使用蒸馏水、乙醇洗涤,使用乙醇洗涤的目的是___________。
(6)制备过氧化钙的另一种方法是:将石灰石煅烧后,直接加入双氧水反应,过滤后可得到过氧化钙产品。该工艺方法的优点是______________,产品的缺点是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是 ( )
A. 50ml,12mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA
B. 常温常压下4.4g乙醛所含σ键数目为0.7NA
C. 向浓H2SO4中通入H2S气体,1mol浓H2SO4转移电子数一定是2 NA
D. 2.0gH218O与D2O的混合物中所含中子数为NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com