

 ,故答案为:
,故答案为: ;
;
| ||
| △ |
| ||
| △ |


科目:高中化学 来源: 题型:
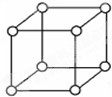 查资料表知,只有钋的晶体中的原子具有如图所示的堆积方式,钋的外围电子排布式是6s26p4.下列关于钋的说法错误的是( )
查资料表知,只有钋的晶体中的原子具有如图所示的堆积方式,钋的外围电子排布式是6s26p4.下列关于钋的说法错误的是( )| A、右图的堆积方式空间利用率太低,金属极少采取这种堆积方式 |
| B、钋晶体中原子的配位数为 6 |
| C、钋基态原子的能层数=周期序数=价电子数 |
| D、钋的常见化合价为+4、+6、-2价 |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
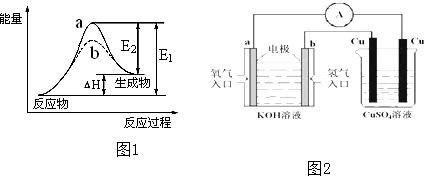
 如图,X是直流电源.Y槽中c、d为石墨棒,Z槽中e、f是质量相同的铜棒.接通电路后,发现d附近显红色.
如图,X是直流电源.Y槽中c、d为石墨棒,Z槽中e、f是质量相同的铜棒.接通电路后,发现d附近显红色.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
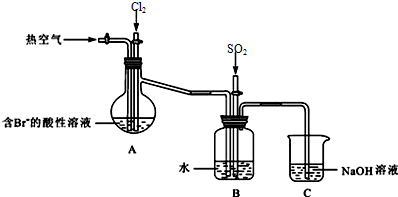
查看答案和解析>>
科目:高中化学 来源: 题型:
 据图回答下列问题:
据图回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:

| t/s | 0 | 500 | 1000 |
| c(N2O5)/mol?L-1 | 5.00 | 3.52 | 2.48 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com