
 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源:2017届江苏省高三上12月月考化学卷(解析版) 题型:选择题
pC类似于pH,是指极稀溶液中的溶质浓度的常用对数的负值。如某溶液中某溶质的浓度为1×10-3 mol·L-1,则该溶液中该溶质的pC=-lg(1×10-3)=3。如图为25℃时H2CO3溶液的pC-pH图(若离子浓度小于10-5 mol·L-1,可认为该离子不存在)。下列说法不正确的是

A.某温度下,CO2饱和溶液的浓度是0.05 mol•L-1,其中1/5的CO2转变为H2CO3,若此时溶液的pH约为5,据此可得该温度下CO2饱和 溶液中H2CO3的电离度约为0.1% ,
溶液中H2CO3的电离度约为0.1% ,
B.25℃时,H2CO3一级电离平衡常数的数值Ka1=10-6
C.向Na2CO3溶液中滴加盐酸至pH等于11时,溶液中:c(Na+)+c(H+)=2c(CO32﹣)+c(OH﹣)+c(HCO3﹣)
D.25℃时,0.1 mol·L-1Na2CO3中c(HCO3﹣)比0.1 mol·L-1NaHCO3中c(HCO3﹣)大
查看答案和解析>>
科目:高中化学 来源:2017届河南省高三上周考五化学试卷(解析版) 题型:实验题
苯甲酸广泛应用于制药和化工行业,某同学尝试用甲苯的氧化反应制备苯甲酸。反应原理:
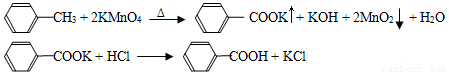
己知甲苯的熔点为-95°C,沸点为110.6°C,易挥发,密度为0.866g/cm3;苯甲酸的熔点为122.4°C,在25°C和95°C下溶解度分别为0.3g和6.9g。
【制备产品】将30.0mL甲苯和25.0mLlmol/L高锰酸钾溶液在100°C下反应30min,装置如图所示。
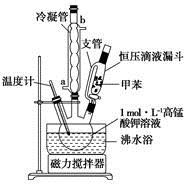
(1)图中冷凝管的进水口为________(填“a”或“b”)。支管的作用是___________。
(2)在本实验中,三领烧瓶最合适的容积___________(填字母)。
A.50mL | B.I00mL | C.200mL | D.250mL |
相对于用酒精灯直接加热,用沸水浴加热的优点是___________________。
【分离产品】该同学设计如下流程分离粗产品苯甲酸和回收甲苯
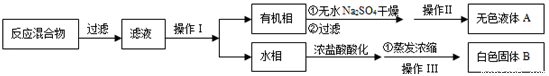
(3)操作Ⅰ的名称是 ;含有杂志的产物经操作Ⅱ进一步提纯得无色液体甲苯,则操作Ⅱ的名称是 。
(4)测定白色固体的熔点,发现其在115℃开始熔化,达到130℃时仍有少量不熔,该同学推测白色固体是苯甲酸与KCl的混合物,设计了如下方案进行提纯和检验,实验结果表明推测正确。请完成表中内容。
序号 | 实验方案 | 实验现象 | 结论 |
① | 将白色固体加入水中,加热溶解,______。 | 得到白色晶体和无色溶液 |
|
② | 取少重滤液于试管中,________。 | 生成白色沉淀 | 滤液含Cl- |
③ | 干燥白色晶体,________。 | _____________________ | 白色晶体是苯甲酸 |
纯度测定:称取1.220g产品,配成100ml甲醇溶液,取25.00ml溶液,用0.1000mol/L KOH标准溶液滴定,重复滴定四次,每次消耗的体积如下表所示。
| 第一次 | 第二次 | 第三次 | 第四 |
体积(mL) | 24.00 | 24.10 | 22.40 | 23.90 |
(5)滴定操作中,如果对装有KOH标准溶液的滴定管读数时,滴定前仰视,滴定后俯视则测定结果______________(填“偏大”、“偏小”或“不变”)。计算样品中苯甲酸纯度为______________。
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上五调考试化学卷(解析版) 题型:选择题
下列各组离子或分子能大量共存,当加人相应试剂后,发生反应的离子方程式书写正确的是( )
选项 | 离子组 | 加人试剂 | 加人试剂后发生反应的离子方程式 |
A. | NH4+、Fe2+、SO42- | 少量Ba(OH)2溶液 | 2NH4++ SO42- + 2OH- = BaSO4↓+ 2NH3 • H2O |
B. | Na+、OH-、Cl- | 少量Mg(HCO3)2溶液 | Mg2++2HCO3-+4OH-=2H2O+Mg(OH)2↓+2CO32- |
C. | K+、NH3·H2O、CO32- | 通人少量CO2 | 2OH-+CO2=CO32-+H2O |
D. | Fe2+、NO3-、HSO3- | NaHSO4溶液 | HSO3- +H+ = SO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高一月考二化学卷(解析版) 题型:填空题
Ⅰ.现有下列十种物质: ①O2; ②Fe; ③CaO; ④CO2; ⑤H2SO4; ⑥Ba(OH)2;⑦红褐色的氢氧化铁胶体; ⑧硫酸钠溶液; ⑨稀硝酸; ⑩Cu2(OH)2CO3。
(1)按物质的树状分类法填写表格的空白处:
分类标准 | 金属单质 | 氧化物 | 溶液 | 胶体 |
属于该类的物质 | ② | ⑧⑨ |
(2)上述物质中属于非电解质的有_________;上述物质中能与盐酸反应的电解质有________(填序号)。
Ⅱ.(1)在 KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O 的反应中,氧化剂是_________,还原产物是_________,氧化产物与还原产物的质量比是_________。
(2)在反应 MnO2+4HCl=MnCl2+Cl2↑+2H2O 中,每生成标准状况下4.48LCl2,转移的电子的物质的量为___________mol。
Ⅲ.Mn2+、 Bi3+、 BiO3-、 MnO4-、 H+、 H2O 组成的一个氧化还原反应体系中,发生BiO3-→Bi3+的反应过程,据此回答下列问题:
将以上物质分别填入下面对应的横线上,组成一个未配平的化学方程式。
________+ _________+ ________→ _________+ ________+H2O
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高一月考二化学卷(解析版) 题型:选择题
同温同压下, a g 甲气体和 2a g 乙气体所占的体积之比为 1: 2,根据阿伏加德罗定律判断,下列叙述不正确的是( )
A. 同温同压下甲和乙的密度之比为 1: 1
B. 甲与乙的相对分子质量之比为 1: 1
C. 同温同体积下等质量的甲和乙的压强之比为 1: 1
D. 等质量的甲和乙中的原子数之比为 1: 1
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二12月月考化学卷(解析版) 题型:填空题
FeCl3 具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3 高效,且腐蚀性小。(已知25℃,Ksp[Fe(OH)3]=4.0×10-38,lg2=0.3)
请回答下列问题:
(1)FeCl3净水的原理是  。(用离子方程式表示),Fe3+水解生成的Fe(OH)3胶体粒子能吸附水中的悬浮杂质,常温下此反应的平衡常数为
。(用离子方程式表示),Fe3+水解生成的Fe(OH)3胶体粒子能吸附水中的悬浮杂质,常温下此反应的平衡常数为  (填写数值)。
(填写数值)。
(2)将FeCl3 溶液与NaHCO3 溶液混合,其离子方程式为 。
(3)25℃时pH=3的溶液中,c(Fe3+)=  mol
mol •L-1。
•L-1。
(4)FeCl3 在溶液中分三步水【解析】
Fe3++H2O Fe(OH)2++H+ K1
Fe(OH)2++H+ K1
Fe(OH)2++H2O Fe(OH)2++H+ K2
Fe(OH)2++H+ K2
Fe(OH)++H2O Fe(OH)3+H+ K3
Fe(OH)3+H+ K3
以上水解反应的平衡常数K1、K2、K3由大到小的顺序是 。
通过控制条件,以上水解产物聚合,生成聚合氧化铁,离 子方程式为:xFe3++yH2O
子方程式为:xFe3++yH2O Fex+yH+,欲使平衡正向移动可采用的方法是(填序号) 。
Fex+yH+,欲使平衡正向移动可采用的方法是(填序号) 。
a.降温 b.加水稀释 c.加入NH4Cl d.加入NaHCO3
(5) FeCl3溶液可腐蚀印刷电路板,其反应为Cu +2FeCl3 =CuCl2+2FeCl2 要将此反应设计在原电池中进行,则正极反应式为 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二12月月考化学卷(解析版) 题型:选择题
有Xn+、Ym+、Zn-三种离子,已知m>n,且X、Y、Z三种原子的M电子层中的电子数均为奇数,若按X→Y→Z的顺序,下列说法正确的是
A. 最高价氧化物对应的水化物的碱性依次减弱
B. 原子半径依次增大
C. 元素的第一电离能依次减小,电负性依次增大
D. 原子序数依次减小
查看答案和解析>>
科目:高中化学 来源:2017届江西师大附中高三12月月考化学试卷(解析版) 题型:选择题
通常人们把拆开1mol某化学键所消耗的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应物的总键能与生成物的总键能之差。工业上高纯硅可通过下列反应制取:SiCl4(g)+2H2(g) Si(s)+4HCl(g),该反应的反应热△H为
Si(s)+4HCl(g),该反应的反应热△H为
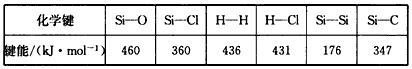
A.+412kJ/mol B.-412kJ/mol C.+236kJ/mol D.-236kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com