
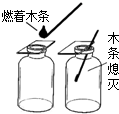
 观察如图中的有关操作和现象,判断下列叙述正确的是( )
观察如图中的有关操作和现象,判断下列叙述正确的是( )| A、集气瓶中的气体可能是CO2 |
| B、集气瓶中的气体可能是空气 |
| C、集气瓶中的气体一定是O2 |
| D、集气瓶中的气体一定是N2 |
 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
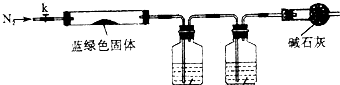
| 实验方案 | 实验现象与结论 |
| 取少量干燥的蓝绿色固体于试管中, |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
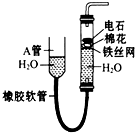 如图中的实验装置可用于制取乙炔.请填空:
如图中的实验装置可用于制取乙炔.请填空:查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com