

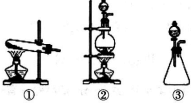
分析 (1)依据反应物状态和反应条件选择发生装置;
(2)依据氯气不具有漂白性,次氯酸具有漂白性,结合从A中出来的气体的成分解答;
(3)实验II①依据m=CVM计算需要溶质的质量;
②配制溶液的应在容量瓶中配制,依据配制溶液体积选择合适规格的容量瓶;
③依据定容的正确操作解答;
(4)溶液具有均一性,依据盐酸与氢氧化钠反应关系n(HCl)=n(NaOH)计算盐酸的物质的量浓度;
(5)依据MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O可知反应后溶液中剩余物为盐酸和氯化锰,n(Cl-)>n(H+),据此解答.
解答 解:(1)MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,反应物为固体和液体,反应条件为加热,所以应选择装置②,故答案为:②;
(2)氯气不具有漂白性,次氯酸具有漂白性,从A中出来的气体汉阳水蒸气,能够与氯气反应生成次氯酸,所以B和C中布条都褪色;
故答案为:不能;进入B装置的氯气中混有水蒸气;
(3)实验II①配制100mL1.00mol?L-1的NaOH溶液,需要氢氧化钠的质量m=1.00mol/L×0.1L×40g/mol=4.0g;
故答案为:4.0;
②配制100mL1.00mol?L-1的NaOH溶液,需要选择100mL容量瓶;
故答案为:100mL容量瓶;
③定容时,继续加蒸馏水至离刻度线1~2cm处,改用胶头滴管滴加蒸馏水至凹槽面最低处与刻度线相切;
故答案为:胶头滴管;
(4)设反应后剩余盐酸的物质的量浓度为C,则依据盐酸与氢氧化钠反应关系n(HCl)=n(NaOH)得11.80mL×1.00mol/L=2.00mL×C,解得C=5.90mol/L,
故答案为:5.90;
(5)依据MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O可知反应后溶液中剩余物为盐酸和氯化锰,n(Cl-)>n(H+),所以通过测Cl-浓度来推测反应后A中残余盐酸的浓度,取2.00mL反应后A中的溶液,加2.00mol?L-1AgNO3溶液至不再产生沉淀时,发现所加的AgNO3溶液的体积远大于理论值5.80mL;
故答案为:残余溶液中,n(Cl-)>n(H+).
点评 本题考查了氯气的实验室制备方法和氯气的性质检验,以及配制一定物质的量浓度溶液,明确氯气制备原理及性质、熟悉配制一定物质的量浓度溶液的一般步骤即可解答,题目难度不大.


科目:高中化学 来源: 题型:选择题
| 序号 | 电极1 | 电极2 | 溶液 |
| A | Cu | Cu | 稀H2SO4 |
| B | Ag | Zn | 稀H2SO4 |
| C | Cu | Cu | 酒精 |
| D | C | C | ZnSO4溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
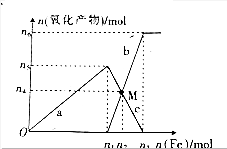 与加入铁粉的物质的量的关系如图所示.
与加入铁粉的物质的量的关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.| 实验现象 | 原因 |
| 溶液最初从紫色逐渐变为红色 | 氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 | _氯气与水反应生成的HClO将石蕊氧化为无色物质 |
| 然后溶液从无色逐渐变为浅黄绿色 | 继续通入的氯气溶于水使溶液呈浅黄绿色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 发生还原反应的是C2O42- | |
| B. | 该离子方程式右侧横线上的产物是OH- | |
| C. | 10molH+参加反应时,电子转移5mol | |
| D. | 该反应的氧化剂为KMnO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com