
| A. | AlCl3溶液和Al2(SO4)3溶液加热、蒸发、浓缩、结晶、灼烧,所得固体的成分相同 | |
| B. | 配制FeCl3溶液时,将FeCl3固体溶解在硫酸中,然后再用水稀释到所需的浓度 | |
| C. | TiCl4+(x+2)H2O(过量)?TiO2•xH2O↓+4HCl 工业上利用该反应制备TiO2纳米粉 | |
| D. | 泡沫灭火器中常使用的原料是碳酸钠和硫酸铝 |
分析 A.氯化铝溶液中氯化铝水解生成氢氧化铝和盐酸,蒸发氯化氢挥发得到水解产物,硫酸铝水解生成硫酸和氢氧化铝,蒸发式蒸出水达到原硫酸铝;
B.氯化铁水解生成氢氧化铁和盐酸,为抑制水解应加入酸,但将FeCl3固体溶解在硫酸中会引入硫酸根离子杂质;
C.四氯化钛水解生成盐酸和氢氧化钛沉淀;
D.泡沫灭火器中常使用的原料是碳酸氢钠和硫酸铝.
解答 解:A.氯化铝溶液中氯化铝水解生成氢氧化铝和盐酸,AlCl3+3H2O?Al(OH)3+3HCl,蒸发氯化氢挥发得到水解产物,硫酸铝水解生成硫酸和氢氧化铝,Al2(SO4)3+6H2O?2Al(OH)3+3H2SO4,蒸发式蒸出水达到原硫酸铝,加热、蒸发、浓缩、结晶、灼烧,所得固体的成分不相同,故A错误;
B.将FeCl3固体溶解在硫酸中会引入硫酸根离子杂质,应溶解在盐酸溶液中,故B错误;
C.TiCl4+(x+2)H2O(过量)?TiO2•xH2O↓+4HCl 工业上利用该反应制备TiO2纳米粉,故C正确;
D.泡沫灭火器中常使用的原料是碳酸氢钠和硫酸铝,故D错误;
故选C.
点评 本题考查了盐类水解原理及其应用,注意理解水解产物,蒸干溶液得到固体成分的判断,题目难度中等.


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6 g碳完全燃烧时放出热量196.8 kJ | |
| B. | CO的燃烧热△H=-283.0 kJ/mol | |
| C. | H2的燃烧热△H=-241.8 kJ/mol | |
| D. | 制备水煤气的反应热△H=+131.3 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
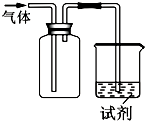 如图装置可用于收集气体并验证其化学性质,下列对应关系完全正确的是( )
如图装置可用于收集气体并验证其化学性质,下列对应关系完全正确的是( )| 选项 | 气体 | 试剂 | 现象 | 结论 |
| A | NO | 紫色石蕊试液 | 溶液变红 | NO与水反应生成硝酸 |
| B | Cl2 | KI淀粉溶液 | 溶液变蓝 | Cl2有氧化性 |
| C | SO2 | 酸性KMnO4溶液 | 溶液褪色 | SO2有漂白性 |
| D | NH3 | 酚酞试剂 | 溶液变红 | NH3有碱性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将输油铁管埋在潮湿.疏松的土壤中 | |
| B. | 经常用自来水冲洗钢铁制品 | |
| C. | 将输送自来水的铁管表面镀锌 | |
| D. | 把钢铁雕塑焊接在铜质基座上 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com