
分析 (1)Mn为第ⅤⅢ族元素,最后填充电子为d电子;
(2)基态Ti2+价电子排布式为:3d2,最高能层为M层,该能层下含有1个3s轨道、3个3p轨道和5个3d轨道,共有9个原子轨道;
BH4-中B原子价层电子对=4+$\frac{1}{2}$(3+1-4×1)=4,且没有孤电子对;
(3)乙醛分子中甲基上碳原子含有4个σ键,醛基上的碳原子含有3个σ键,据此判断碳原子的杂化方式,碳原子杂化方式不同导致其键角不同;
(4)①非金属性越强,电负性越大;
②等电子体中原子数、价电子数相同;
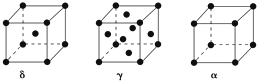
(5)δ-Fe为体心立方密堆积,配位数为8,γ-Fe为面心立方密堆积,配位数为12,α=Fe为简单立方堆积,配位数为6;设原子半径为y,δ中体对角线为4r,γ中面对角线为4r、α中棱长为2r,以此计算.
解答 解:(1)Mn为第ⅤⅢ族元素,最后填充电子为d电子,则位于d区,故答案为:d;
(2)基态Ti2+价电子排布式为:3d2,最高能层为M层,该能层下含有1个3s轨道、3个3p轨道和5个3d轨道,共有9个原子轨道,BH4-中B原子价层电子对=4+$\frac{1}{2}$(3+1-4×1)=4,且没有孤电子对,则为正四面体型,
故答案为:M;9;正四面体型;
(3)乙醛分子中甲基上碳原子含有4个σ键,醛基上的碳原子含有3个σ键,所以甲基中的碳原子采用sp3杂化,醛基中的碳原子采用sp2杂化,醛基中碳原子采用sp2杂化、乙醇中含有醇羟基的碳原子采用sp3杂化,导致乙醛分子中H-C-O的键角大于乙醇分子中的H-C-O的键角,
故答案为:sp3、sp2;大于;
(4)①非金属性越强,电负性越大,则电负性为H<C<N<O,故答案为:H<C<N<O;
②与CN-互为等电子体微粒的化学式为CO(或N2等),故答案为:CO(或N2等);
(5)δ-Fe为体心立方密堆积,配位数为8,γ-Fe为面心立方密堆积,配位数为12,α=Fe为简单立方堆积,配位数为6,则δ、γ、α三种晶胞中铁原子的配位数之比为8:12:6=4:6:3,
设原子半径为y,δ中体对角线为4r,若设棱长为x,则x2+($\sqrt{2}$x)2=(4r)2,解得x=$\frac{2r}{\sqrt{3}}$;
γ中面对角线为4r,若设棱长为y,则y2+y2=(4r)2,解得y=2$\sqrt{2}$r;
α中棱长为2r,
则三种晶胞中棱长之比为$\frac{2r}{\sqrt{3}}$:2$\sqrt{2}$r:2r=$\frac{1}{\sqrt{3}}$:$\sqrt{2}$:1,
故答案为:4:6:3;$\frac{1}{\sqrt{3}}$:$\sqrt{2}$:1.
点评 本题考查晶胞计算、分子空间构型、电负性等,为高频考点,把握物质的结构与性质的关系等为解答的关键,侧重分析与应用能力的考查,注意(5)为解答的难点,题目难度不大.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苹果放在空气中久置变黄和纸张久置变黄原理相似 | |
| B. | 油脂在人体内水解为氨基酸和甘油等小分子才能被吸收 | |
| C. | 现代科技已经能够拍到氢键的“照片”,直观地证实了水分子间的氢键是一个水分子中的氢原子与另一个水分子中的氧原子间形成的化学键 | |
| D. | 3D打印技术采用钛合金粉末为原料制造飞机钛合金结构件,高温时可用金属钠还原钛的氯化物制取金属钛 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大分子化合物油脂在人体内水解为氨基酸和甘油等小分子才能被吸收 | |
| B. | 包装食品里常有硅胶、石灰、还原铁粉三类小包,其作用相同 | |
| C. | Na2SiO3水溶液俗称水玻璃,是制备硅胶和木材防火剂的原料 | |
| D. | 为测定新制氯水的pH,用玻璃棒蘸取液体滴在pH试纸上,与标准比色卡对照即可 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
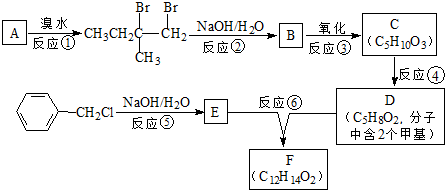
 .
.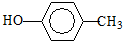 :
: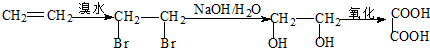 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生活中钢铁制品生锈主要是由于吸氧腐蚀所致,将锌块与钢铁输水管相连,可防止钢铁腐蚀 | |
| B. | 汽车尾气中除含有NOx,还含有PM2.5容易形成雾霾,“雾霾”的分散质微粒相同 | |
| C. | 双氧水、高锰酸钾溶液可以消灭病毒,其消毒原理和漂白粉消毒饮用水相同 | |
| D. | 我国已能利用3D打印技术,以钛合金粉末为原料,通过激光熔化逐层堆积,来制造飞机钛合金结构件,高温时可用金属钠还原相应的氯化物来制取金属钛 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在羽毛球、网球等体育项目中做球拍的碳纤维材料是一种新型无机非金属材料 | |
| B. | 从海水中提取溴和镁都必须通过化学反应才能实现 | |
| C. | 聚乙烯塑料的老化是由于发生了加成反应 | |
| D. | 用饱和NH4Cl溶液可除去铁表面的锈斑 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素的非金属性顺序为a>b | |
| B. | a和c形成的离子化合物中可能含有共价键 | |
| C. | d的最高价氧化物对应的水化物可溶于c的最高价氧化物对应水化物的水溶液 | |
| D. | 五种元素离子半径最小的是d |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同条件下,测得Na2CO3溶液的pH大于相同物质的量浓度的Na2SO3溶液,说明非金属性:C<S | |
| B. | 绝热容器中,向50 mL 1 mol•L-1的盐酸中加入烧碱,水的KW不变 | |
| C. | 相同温度时,BaSO4分别在相同物质的量浓度的Na2SO4溶液和Al2(SO4)3溶液中的溶解度相同 | |
| D. | 有HX和HY两种弱酸且酸性HX>HY,则物质的量浓度相同的NaX和NaY两溶液等体积混合的溶液中有 c(X-)>c(Y-)>c(OH-)>c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com