
【题目】我国古代青铜器工艺精湛,有很高的艺术价值和历史价值,但出土的青铜器易受到环境腐蚀,所以对其进行修复和防护具有重要意义。
(1)采用“局部封闭法”可以防止青铜器进一步被腐蚀。如将糊状Ag2O涂在被腐蚀部位,Ag2O与有害组分CuCl发生复分解反应,该化学方程式为_________________________________________________。
(2)下图为青铜器在潮湿环境中发生的电化学腐蚀的示意图。

①腐蚀过程中,负极是_____(填“a”“b”或“c”);
②环境中的Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔铜锈Cu2(OH)3Cl,其离子方程式为_______________;
③若生成4.29 g Cu2(OH)3Cl,则理论上耗氧体积为______L(标准状况)。
【答案】 Ag2O+2CuCl===2AgCl+Cu2O c Cu2++3OH-+Cl-===Cu2(OH)3Cl↓ 0.448
【解析】(1)复分解反应为相互交换成分的反应,因此该反应的化学方程式为Ag2O+2CuCl===2AgCl+Cu2O。(2)①负极发生失电子的反应,铜作负极失电子,因此负极为c,其中负极反应:Cu-2e-===Cu2+,正极反应:O2+2H2O+4e-===4OH-;②正极产物为OH-,负极产物为Cu2+,两者与Cl-反应生成Cu2(OH)3Cl,其离子方程式为2Cu2++3OH-+Cl-===Cu2(OH)3Cl↓;③4.29 g Cu2(OH)3Cl的物质的量为0.02 mol,由Cu元素守恒知,发生电化学腐蚀失电子的Cu单质的物质的量为0.04 mol,失去电子0.08 mol,根据电子守恒可得,消耗O2的物质的量为0.08mol÷4=0.02 mol,所以理论上消耗氧气的体积为0.448 L(标准状况)。


科目:高中化学 来源: 题型:
【题目】实验室需要1.2mol·L-1NaOH溶液80mL,步骤如下:
(1)选择仪器:有如图所示的仪器,配制溶液一定不需要的是___________(填序号);

除以上仪器外,还需用到的玻璃仪器是___________(填仪器名称)。
(2)计算:根据计算结果得知,用托盘天平称取NaOH固体的质量应为___________g。
(3)称量:调节天平平衡时,发现指针在分度盘的偏右位置,此时应向___________(填“左”或“右”)调节螺母以使天平平衡。
称量一个小烧杯的质量。下图表示称量小烧杯的过程:“↓”表示在托盘上放上砝码,“↑”表示从托盘上取下砝码(5g以下用游码)。
砝码质量/g | 50 | 20 | 20 | 10 | 5 |
称量(取用砝码过程) | ↓↑ | ↓ | ↓↑ | ↓ | ↓↑ |
标尺上游码的位置:
![]()
由以上图示可知,小烧杯的质量为___________g。
(4)溶解,冷却。
(5)移液、洗涤:洗涤2~3次的目的是___________。
(6)定容、摇匀。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常压下羰基化法精炼镍的原理为:Ni(s)+4CO(g)![]() Ni(CO)4(g) △H<0 230℃时,该反应的平衡常数K=2×10-5。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
Ni(CO)4(g) △H<0 230℃时,该反应的平衡常数K=2×10-5。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍,
下列判断错误的是
A. 第一阶段,选择反应温度应髙于42.2℃
B. 第一阶段增加c(CO),平衡向正向移动,反应的平衡常数不变
C. 第二阶段,Ni(CO)4几乎完全分解
D. 第二阶段,及时分离出Ni,有利于平衡移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,某容器中加入足量碳酸钙,发生反应CaCO3(s) ![]() CaO(s)+CO2(g)达到平衡,下列说法正确的是
CaO(s)+CO2(g)达到平衡,下列说法正确的是
A.将体积缩小为原来的一半,当体系再次达到平衡时,CO2的浓度为原来的2倍
B.CaCO3(s)加热分解生成CaO(s)和CO2,△s<0
C.将体积增大为原来的2倍,再次达到平衡时,气体密度不变
D.保持容器体积不变,充入He,平衡向逆反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】BHT是一种常用的食品抗氧化剂,由对甲基苯酚(![]() )合成BHT的常用方法有2种(如图),下列说法不正确的是
)合成BHT的常用方法有2种(如图),下列说法不正确的是

A. BHT能使酸性KMnO4溶液褪色
B. BHT与对甲基苯酚互为同系物
C. BHT中加入浓溴水易发生取代反应
D. 方法一的原子利用率高于方法二
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为氢氧燃料电池构造示意图,按照此图的提示,下列叙述不正确的是

A.a 电极是负极
B.电子由b 通过灯泡流向 a
C.氢氧燃料电池是一种具有应用前景的绿色电源
D.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从含铅废料(PbSO4、PbO2、PbO等)中回收铅,实现铅的再生意义重大。一种回收铅的工作流程如下:
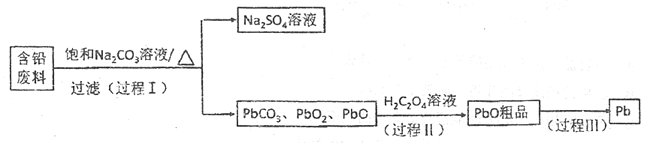
(1)铅和碳元素同主族,比碳多4个电子层,则铅元素的原子序数为______;铅蓄电池放电对,PbO2作______极。
(2)过程Ⅰ,已知:PbSO4、PbCO3的溶解度(20℃)见图1;相关物质溶解度见图2。

图1 图2
①根据图1写出过程Ⅰ的离子方程式: __________________。
②生产过程中的温度应保持在40℃,若温度降低,PbSO4的转化速率下降。根据图2,解释原因:
i.温度降低,反应速率降低;
ii.___________________(请你提出一种合理解释)
(3)过程Ⅱ:发生反应2PbO2+H2C2O4=2PbO+H2O2+2CO2↑
请写出草酸的电子式________。PbO与Al2O3性质相似,PbO与氢氧化钠溶液反应的离子方程式是______________________。
(4)过程Ⅲ:将PbO粗品溶解在H2SO4和NaCl的混合溶液中,得到含Na2PbCl4的电解液,电解Na2PbCl4溶液生成Pb,如图。

①阴极的电极反应式是_____________________。
②电解一段时间后,Na2PbCl4浓度极大下降,为了能使电解过程持续进行,阴极区采取的方法是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图装置(夹持、加热装置已略)进行试验,由②中现象,不能证实①中反应发生的是

①中实验 | ②中现象 | |
A | NaHCO3固体受热分解 | 澄清石灰水变浑浊 |
B | 加热NH4Cl和Ca(OH)2的混合物 | 酚酞溶液变红 |
C | 铁粉与水蒸气加热 | 肥皂水冒泡 |
D | 石蜡油在碎瓷片上受热分解 | Br2的CCl4溶液褪色 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在298K时,实验测得溶液中的反应:H2O2+2HI=2H2O+I2,在不同浓度时的化学反应速率见表,由此可推知当c(HI)=0.500mol·L-1,c(H2O2)=0.400mol·L-1时的反应速率为( )
实验编号 | 1 | 2 | 3 | 4 | 5 |
c(HI)/mol·L-1 | 0.100 | 0.200 | 0.300 | 0.100 | 0.100 |
c(H2O2)/mol·L-1 | 0.100 | 0.100 | 0.100 | 0.200 | 0.300 |
v/mol·L-1·s-1 | 0.00760 | 0.0153 | 0.0227 | 0.0151 | 0.0228 |
A.0.0380mol·L-1·s-1B.0.152mol·L-1·s-1
C.0.608mol·L-1·s-1D.0.760mol·L-1·s-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com