
| 物质 | Cu(OH)2 | Fe(OH)3 |
| Ksp | 2.2×10-20 | 2.6×10-39 |
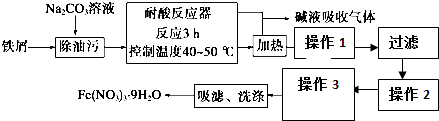
分析 含有铜的细铁屑加入Na2CO3溶液可以除油污,在耐酸反应器中,控制温度40℃-50℃反应3小时,铁和硝酸生成硝酸铁,铜和硝酸生成硝酸铜,同时生成氮的氧化物,用碱液吸收,操作1加入烧碱溶液,调节pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,因KKsp(Cu(OH)2)>Ksp(Fe(OH)3),所以过滤,铜离子在滤液中,操作2是在滤渣Fe(OH)3沉淀中加入足量的硝酸,硝酸和氢氧化铁反应生成易溶的硝酸铁,Fe(NO3)3•9H2O为结晶水合物,防止结晶过程结晶水散失,所以操作3通过蒸发浓缩、冷却结晶得到,Fe(NO3)3•9H2O易溶于水,微溶于硝酸,制得的Fe(NO3)3•9H2O用20% HNO3洗涤,可洗去表面杂质,同时防止因溶解而造成的损失.
(1)碳酸钠在溶液中水解显碱性,可以除油污;
(2)先根据溶液的pH计算氢离子浓度,再结合水的离子积常数计算氢氧根离子浓度,最后根据c(Fe3+)=$\frac{{K}_{W}[Fe(OH)_{3}]}{{C}^{3}(O{H}^{-})}$计算铁离子浓度;Fe3+小于1.0×10-5mol.L-1时,视为完全沉淀;
(3)操作2是在滤渣Fe(OH)3沉淀中加入足量的硝酸,硝酸和氢氧化铁反应生成易溶的硝酸铁,在酸性条件下可抑制铁离子的水解;
(4)操作3包含两步得到Fe(NO3)3•9H2O,该晶体为结晶水合物,所以需冷却结晶;
(5)制得的Fe(NO3)3•9H2O用20% HNO3洗涤,能洗涤晶体表面的杂质,降低晶体溶解性,减少晶体损耗.
解答 解:(1)油污在碱性条件下课水解生成易溶于水的甘油、和高级脂肪酸钠,碳酸钠在溶液中水解显碱性,可以除油污,其水解的离子方程式为:CO32-+H2O?HCO3-+OH-,
故答案为:CO32-+H2O?HCO3-+OH-;
(2)溶液的pH=4,所以溶液中氢离子浓度为10-4 mol/L,则氢氧根离子浓度为10-10 mol/L,c(Fe3+)=$\frac{{K}_{W}[Fe(OH)_{3}]}{{C}^{3}(O{H}^{-})}$=$\frac{2.6×1{0}^{-39}}{(1.0×1{0}^{-10})^{3}}$mol/Lmomol=2.6×10-9mol/L,c(Fe3+)<10-5mol/L,Fe3+已经沉淀完全,
故答案为:2.6×10-9mol/L;是;
(3)操作2是在滤渣Fe(OH)3沉淀中加入足量的硝酸,硝酸和氢氧化铁反应:Fe(OH)3+3HNO3=Fe(NO)3+3H2O,硝酸铁易溶于水,在水中Fe3++3H2O?Fe(OH)3+3H+,在酸性条件下可抑制铁离子的水解,
故答案为:将Fe(OH)3完全溶解,抑制Fe3+水解;
(4)操作3包含两步得到Fe(NO3)3•9H2O,该晶体为结晶水合物,防止结晶过程结晶水散失,所以需蒸发浓缩、冷却结晶,
故答案为:蒸发浓缩、冷却结晶;
(5)Fe(NO3)3•9H2O易溶于水,微溶于硝酸,制得的Fe(NO3)3•9H2O用20%HNO3洗涤的目的是洗去晶体表面的杂质,不引入新的杂质,同时能减少晶体损耗,
故答案为:洗去表面杂质,减少因溶解而造成的损失.
点评 本题以制备Fe(NO3)3•9H2O晶体为载体,考查了物质制备实验的设计和分析,物质的分离与提纯,实验能力和分析能力的考查,注意把握流程中的反应条件和反应实质理解是解题关键,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 乙醇使酸性K2Cr2O7溶液由橙色变为绿色 | |
| B. | 向品红溶液中通入SO2气体,品红褪色,加热后又恢复红色 | |
| C. | 将铜丝在空气中烧黑后.趁热插入乙醇中又变红 | |
| D. | 将乙醛加人到新制Cu(OH)2悬浊液中并加热至沸腾,出现红色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2 | B. | NH3 | C. | Cl2 | D. | NO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,14 g 氮气含有的原子数目为 NA | |
| B. | 0.1mol/L BaCl2溶液中Cl-数目是0.2 NA | |
| C. | 标况时,22.4L水所含水分子的数目为1NA | |
| D. | 56g铁与过量硫酸反应,需失去3NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol,则稀H2SO4和稀Ba(OH)2溶液反应生成2 mol H2O的反应热△H=-2×57.3 kJ/mol | |
| B. | 已知S(s)+$\frac{3}{2}$O2(g)═SO3(g)△H=-395.7 kJ/mol,则硫磺的燃烧热为395.7 kJ/mol | |
| C. | 已知C(石墨,s)═C(金刚石,s)△H=+1.9 kJ/mol,则金刚石比石墨稳定 | |
| D. | 已知2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ/mol,则H2的燃烧热为285.8 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应速率变化时,化学平衡一定发生移动 | |
| B. | 正反应进行的程度大、正反应速率一定大 | |
| C. | 化学平衡发生移动时、化学反应速率一定变化 | |
| D. | 只有催化剂存在下,才会发生化学反应速率变化,而化学平衡不移动的情况 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下水电离出的c(H+)•c(OH-)=10-20的溶液中:Na+、Cl-、S2-、SO32- | |
| B. | 滴加无色酚酞后仍为无色的溶液:Na+、CO32-、K+、ClO-、SO42- | |
| C. | 加入(NH4)2Fe(SO4)2•6H2O晶体的溶液中:Na+、H+、Cl-、NO3- | |
| D. | 常温下,pH<7的溶液中:I-、SO42-、Al3+、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 途径①反应中体现了浓硝酸的强氧化性和酸性 | |
| B. | 途径②的第二步反应在实际生产中可以通过增大O2浓度来提高产率 | |
| C. | 由途径①和②分别制取1mol H2SO4,理论上各消耗1mol S,各转移6mol电子 | |
| D. | 途径②与途径①相比更能体现“绿色化学”理念,是因为途径②比途径①污染相对小且原子利用率高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com