
科目:高中化学 来源: 题型:
| A、在稀溶液中,0.55mol Ba(OH)2与l mol HNO3完全反应生成l mol H2O放出的热叫中和热 | B、将2 g NaOH固体加入到100 mL0.5 mol?L-1盐酸中,溶液导电能力变化明显 | C、中和热可表示为△H=一57.3 kJ | D、所有自发进行的反应都是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(10分)实验室要配制100 mL0.5 mol·L-1的NaCl溶液,试回答下列各题:
(1)下列仪器中,肯定不会用到的是( )
A.锥形瓶 B.200mL容量瓶 C.量筒 D.胶头滴管 E.100 mL容量瓶 F.天平
(2)若要实施配制,除上述仪器外,还缺少的仪器或用品是__________________________。
(3)容量瓶上除有刻度线外还应标有__________________,容量瓶在使用前必须进行的一步操作是_________________________。
(4)配制完毕后,教师指出有四位同学各进行了下列某一项错误操作,你认为这四项错误操作会导致所得溶液浓度偏高的是( )
A.定容时仰视容量瓶刻度线
B.定容时俯视容量瓶刻度线
C.将溶解冷却后的溶液直接转入容量瓶后就进行定容操作
D.定容后,把容量瓶倒置摇匀后发现液面低于刻度线,便补充几滴水至刻度处
(5)通过计算可得出可用托盘天平称取NaCl固体________克。若用4 mol/L的NaCl浓溶液配制100 mL 0.5 mol·L-1的稀溶液,应用量筒量取_________mL该浓溶液。
查看答案和解析>>
科目:高中化学 来源:2011-2012届广东省韶关市高三下学期第二次调研考试化学试卷(带解析) 题型:填空题
(16分)草酸(H2C2O4)是一种二元弱酸,主要用作还原剂和漂白剂。草酸的盐可用作碱土金属离子的广谱沉淀剂。
(1)40 ℃时混合一定体积的0.1mol/L H2C2O4溶液与一定体积0.01mol/L酸性KMnO4溶液,填写表中空格。
| 温度 | v(H2C2O4) | v(KMnO4) | KMnO4褪色时间 |
| 40 ℃ | 10 ml | 10 ml | 40 s |
| 40 ℃ | 20 ml | 20 ml | |
 H++In—。则酸根离子In—的颜色是 。甲基橙的酸性与草酸相比, (填前者强、前者弱、十分接近、无法判断)。
H++In—。则酸根离子In—的颜色是 。甲基橙的酸性与草酸相比, (填前者强、前者弱、十分接近、无法判断)。
查看答案和解析>>
科目:高中化学 来源:2011-2011-2012学年广东省韶关市高三下学期第二次调研考试化学试卷(解析版) 题型:填空题
(16分)草酸(H2C2O4)是一种二元弱酸,主要用作还原剂和漂白剂。草酸的盐可用作碱土金属离子的广谱沉淀剂。
(1)40 ℃时混合一定体积的0.1 mol/L H2C2O4溶液与一定体积0.01 mol/L酸性KMnO4溶液,填写表中空格。
|
温度 |
v(H2C2O4) |
v(KMnO4) |
KMnO4褪色时间 |
|
40 ℃ |
10 ml |
10 ml |
40 s |
|
40 ℃ |
20 ml |
20 ml |
|
(2)用甲基橙作指示剂,通过酸碱滴定可测定草酸溶液浓度。甲基橙是一种常用的酸碱指示剂,甲基橙(用化学式HIn表示)本身就是一种有机弱酸,其电离方程式为:HIn H++In—。则酸根离子In—的颜色是
。甲基橙的酸性与草酸相比,
(填前者强、前者弱、十分接近、无法判断)。
H++In—。则酸根离子In—的颜色是
。甲基橙的酸性与草酸相比,
(填前者强、前者弱、十分接近、无法判断)。
(3)常温下有pH均为3的盐酸和草酸溶液各10 ml,加水稀释,在答题卷上画出稀释过程中[来源:Z*xx*k.Com]两种溶液中c(H+)变化的示意图并作必要的标注。
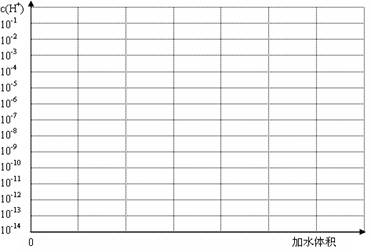
(4)常温下MgC2O4的Ksp=8.1×10-5,已知当溶液中某离子的浓度≤10-5 mol/L时可认为该离子已沉淀完全。现为了沉淀1 L0.01 mol/LMgCl2溶液中的Mg2+,加入100 mL0.1 mol/L的(NH4)2C2O4溶液,通过计算判断Mg2+是否已沉淀完全。
(5)(NH4)2C2O4溶液因NH4+水解程度稍大于C2O42-而略显酸性,0.1 mol/L(NH4)2C2O4溶液pH值6.4。现有某未知溶液,常温下由水电离出的c(H+)=1.0×10-5 mol/L,该溶液pH可能是 (填字母)。
A.5 B.6 C.7 D.9
查看答案和解析>>
科目:高中化学 来源:河南省模拟题 题型:填空题

已知:
①A、B两溶液呈碱性;C、D、E溶液呈酸性。
②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有气体产生(沉淀包括微溶物,下同)。
③D溶液与另外四种溶液反应均能产生沉淀;C只能与D反应产生沉淀。
试回答下列问题:
(1)A、B、C、D、E的化学式分别为_______、________、_______、_______、________;
(2)常温下,浓度均为0.1 mol/L 的A、B溶液中H2O的电离程度的关系是A____(填“<”“>”或“=”)B;
(3)在100 mL0.1mol/L E溶液中,逐滴加入35 mL 2 mol/L NaOH溶液,最终得到沉淀的物质的量为
____mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com